NOTICE
ANSM - Mis à jour le : 15/04/2024
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
Naloxone
Veuillez lire attentivement cette notice avant dutiliser ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien ou votre infirmier/ère.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre médecin, pharmacien ou infirmier/ère pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou votre infirmier/ère. Ceci sapplique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
3. Comment utiliser VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ?
6. Contenu de lemballage et autres informations.
1. QUEST-CE QUE VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose, ET DANS QUELS CAS EST-IL UTILISE ? <
Classe pharmacothérapeutique : Antidotes, code ATC : V03AB15.
VENTIZOLVE contient de la naxolone, une substance active antidote aux opioïdes. Il est indiqué dans le traitement durgence des surdosages caractérisés ou suspectés aux opioïdes (tels que morphine, héroïne, méthadone, fentanyl, oxycodone, ou buprénorphine).
VENTIZOLVE est un spray nasal utilisé dans le traitement durgence des surdosages caractérisés ou suspectés aux opioïdes chez ladulte. Les signes dun tel surdosage incluent :
· Des problèmes pour respirer
· Une somnolence sévère inhabituelle.
· Ne répondant pas à un bruit fort ou au toucher
Si vous êtes à risque de présenter un surdosage aux opioïdes, ayez toujours VENTIZOLVE sur vous.
VENTIZOLVE fonctionne pendant une courte période, pour contrer les effets des opioïdes dans lattente dune prise en charge par les services de secours et une structure médicalisée. Ce nest pas un substitut aux soins de secours durgence.
Prévenez toujours vos amis et votre famille que vous avez VENTIZOLVE sur vous.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DUTILISER VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ? <
Nutilisez jamais VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
· si vous êtes allergique à la naloxone ou à lun des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Ce médicament est utilisé pour le traitement durgence dun surdosage aux opioïdes et doit vous être administré par une autre personne.
VENTIZOLVE doit vous être administré immédiatement et ne remplace pas les équipes médicales durgences.
Contacter les secours immédiatement, même si le patient se réveille. Appelez le 15 ou le 112.
· Le pulvérisateur nasal VENTIZOLVE contient une seule dose de naloxone. Il est important de ne pas amorcer ni tester le pulvérisateur avant son utilisation, au risque quil se vide et que le patient ne reçoive pas la dose nécessaire. Utilisez un second pulvérisateur nasal VENTIZOLVE si des doses supplémentaires sont nécessaires. Des doses supplémentaires peuvent être administrées 2 à 3 minutes après la dose initiale (voir rubrique 3).
· Symptômes du syndrome de sevrage : Il est possible que VENTIZOLVE occasionne une réversion rapide de leffet des opioïdes qui peut causer un syndrome aigu de sevrage chez une personne physiquement dépendante aux opioïdes. Les symptômes du syndrome aigu de sevrage peuvent être : accélération du rythme cardiaque, hypertension artérielle, courbatures et crampes abdominales, diarrhées, nausées, vomissements, sueurs, fièvre, chair de poule, frissons ou tremblements, troubles du comportement incluant comportement violent, nervosité, anxiété, excitation, agitation ou irritabilité, troubles de lhumeur, sensibilité accrue de la peau, difficulté à dormir. Si vous prenez des opioïdes pour soulager une douleur chronique, vous pouvez voir votre douleur augmenter quand vous êtes traité par VENTIZOLVE.
· La durée daction de certains opioïdes peut dépasser celle de VENTIZOLVE. Même si une réponse initiale est observée, il est important que le patient soit mis sous surveillance, car les signes et les symptômes de surdosage aux opioïdes peuvent réapparaitre. Dans ce cas, des doses supplémentaires de VENTIZOLVE peuvent être administrées (voir rubrique 3).
· Si vous utilisez de la buprénorphine, sachez que VENTIZOLVE peut ne pas complètement contrer la détresse respiratoire causée par le surdosage. Une dose supplémentaire peut être nécessaire.
Informez votre médecin si votre muqueuse nasale est endommagée car ceci pourrait affecter le fonctionnement de VENTIZOLVE.
Enfants et adolescents
Ne pas utiliser VENTIZOLVE chez les enfants et les adolescents.
Autres médicaments et VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous prenez ou avez pris des doses élevées d'opioïdes ou des opioïdes à action prolongée, parlez-en à votre médecin.
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose avec de lalcool
Le délai daction de ce médicament peut être retardé chez les patients souffrant dune intoxication causée par les opioïdes et l'alcool.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Une surveillance étroite du ftus ou de lenfant est nécessaire si VENTIZOLVE est utilisé au cours de la grossesse ou de lallaitement.
Conduite de véhicules et utilisation de machines
Les effets causés par les opioïdes pouvant réapparaître, vous ne devez pas conduire dautomobiles ou de machines et ne pas entreprendre dactivités demandant une attention particulière ou une aptitude physique spécifique pendant au moins 24 heures après traitement par VENTIZOLVE.
VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose contient du chlorure de benzalkonium
Ce médicament contient 0,02 mg de chlorure de benzalkonium dans chaque pulvérisateur nasal, ce qui équivaut à 0,2 mg/mL. Le chlorure de benzalkonium peut causer une irritation ou un gonflement dans le nez, surtout s'il est utilisé pendant une longue période.
3. COMMENT UTILISER VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ? <
Adultes :
Une pulvérisation (1,26 mg de naloxone) administrée par voie nasale (dans le nez).
Les premiers secours doivent être administrés jusqu'à larrivée des services de secours durgence. Placez la personne en position latérale de sécurité. Une dose supplémentaire peut être administrée 2 à 3 minutes après ladministration de la première dose si aucun effet clinique significatif n'est atteint ou si l'état du patient ne saméliore pas.
Si deux doses de 1,26 mg de naloxone n'entraînent pas une amélioration significative des symptômes, il faut considérer que les symptômes peuvent être causés entièrement ou partiellement par d'autres facteurs ou substances que les opioïdes.
Mode demploi :
1. Surveillez les symptômes et les réactions.
· Vérifiez si la personne réagit, pour voir si elle est consciente : vous pouvez crier son nom, secouer ses épaules, parler fort dans ses oreilles, frotter son sternum, pincer son oreille ou la base de longle.
· Vérifiez les voies respiratoires et la respiration. Libérez la bouche et le nez de tout obstacle qui pourrait empêcher la respiration. Vérifiez la respiration pendant 10 secondes - est ce que la poitrine se soulève ? Entendez-vous des bruits respiratoires ? Pouvez-vous sentir un souffle en approchant votre joue ?
· Vérifiez les signes dun surdosage, comme : un manque de réponse suite au toucher ou au bruit, une respiration lente ou irrégulière ou pas de respiration, un ronflement, un halètement ou un déglutissement, des lèvres ou des ongles bleus ou violacés.
· Si un surdosage est suspecté, VENTIZOLVE doit être administré.
2. Appelez immédiatement les services de secours en faisant le 15 ou le 112.

3. Allongez la personne sur le dos. Assurez-vous que ses voies respiratoires sont dégagées. Il est recommandé d'inspecter et de dégager les voies nasales avant d'administrer la pulvérisation nasale.
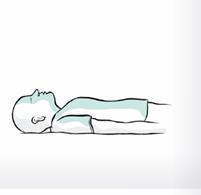
4. Ouvrez l'emballage intérieur en retirant d'abord l'élastique, puis en appuyant au centre des faces plates de la boîte en plastique pour l'ouvrir.
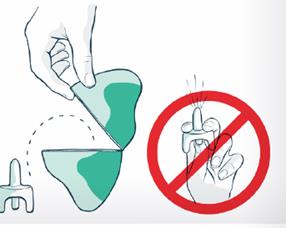
Ne testez pas et namorcez pas le pulvérisateur avant utilisation. Un pulvérisateur de VENTIZOLVE ne contient quune seule dose de naloxone.
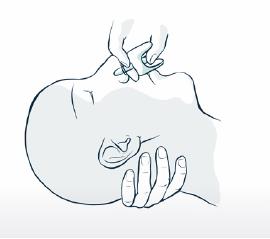
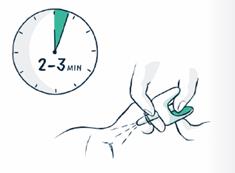
5. Soutenez la nuque pour permettre à la tête de s'incliner vers l'arrière. Placez le pulvérisateur dans une narine. Appuyez fermement sur le piston jusqu'à ce qu'il clique pour administrer la dose, puis retirez le pulvérisateur de la narine.

6. Placez la personne en position latérale de sécurité. Restez auprès delle jusquà larrivée des services de secours. Surveillez toute amélioration de la fréquence respiratoire, de létat déveil ou de la réaction au bruit ou au toucher.
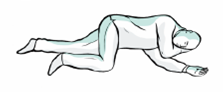
7. S'il n'y a pas d'amélioration après 2 à 3 minutes, une deuxième dose doit être administrée dans lautre narine.
Afin de visualiser la vidéo explicative, veuillez-vous reporter au QR code et à lURL présents en fin de notice.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? <
Il peut être difficile dattester quun effet indésirable est dû à lutilisation de VENTIZOLVE puisque ce médicament est toujours administré secondairement à la prise dopioïdes.
Les effets indésirables suivants ont été rapportés après ladministration de VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose :
Très fréquemment (pouvant affecter plus de 1 personne sur 10) :
· Sensation dêtre malade
Fréquemment (pouvant affecter jusquà 1 personne sur 10) :
· Vertiges, maux de têtes
· Augmentation du rythme cardiaque
· Augmentation ou diminution de la pression artérielle (possibles maux de tête ou sensation de malaise)
· Vomissements
Peu fréquemment (pouvant affecter jusquà 1 personne sur 100) :
· Sueurs, tremblements
· Irrégularités ou diminution du rythme cardiaque
· Diarrhée, sécheresse buccale
· Accélération de la respiration
· Symptômes de sevrage : agitation, irritabilité, augmentation de la sensibilité cutanée, sensation dêtre malade, vomissements, crampes abdominales, crampes musculaires, sautes dhumeur, difficultés dendormissement, anxiété, frissons, sueurs, augmentation du rythme cardiaque, hypertension artérielle, bâillements, fièvre
Très rarement (pouvant affecter jusquà 1 personne sur 10 000) :
· Réactions allergiques : gonflement du visage, de la bouche, des lèvres ou de la gorge, choc allergique
· Troubles du rythme cardiaque potentiellement mortels, crise cardiaque
· Accumulation de liquide dans les poumons
· Troubles cutanés : démangeaisons, éruptions cutanées, rougeurs, enflures, desquamations sévères de la peau
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou à votre infirmier/ère. Ceci sapplique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage dinformations sur la sécurité du médicament.
5. COMMENT CONSERVER VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose ? <
Tenir ce médicament hors de la vue et de la portée des enfants.
Nutilisez pas ce médicament après la date de péremption indiquée sur le flacon, lemballage plastique/plaquette et la boîte après la mention EXP. La date de péremption fait référence au dernier jour de ce mois. Conserver les plaquettes dans lemballage extérieur, à labri de la lumière.
Ne pas congeler. Conserver les récipients unidoses dans leur emballage plastique, à labri de la lumière.
Ne jetez aucun médicament au tout-à-légout ou avec les ordures ménagères. Demandez à votre pharmacien déliminer les médicaments que vous nutilisez plus. Ces mesures contribueront à protéger lenvironnement.
6. CONTENU DE LEMBALLAGE ET AUTRES INFORMATIONS <
Ce que contient VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose <
· La substance active est la naloxone.
Chaque pulvérisation nasale délivre 1,26 mg de naloxone (sous forme de chlorhydrate de naloxone dihydraté)
· Les autres composants sont :
La povidone, le glyécérol, lédétate disodique, le chlorure de benzalkonium, lacide citrique monohydraté, le citrate de sodium, lhydroxyde de sodium (pour lajustement du pH), lacide chlorydrique (pour lajustement du pH), leau pour préparations injectables.
Quest-ce que VENTIZOLVE 1,26 mg, solution pour pulvérisation nasale en récipient unidose, et contenu de lemballage extérieur <
VENTIZOLVE est une solution limpide et incolore emballée dans un flacon en verre avec un bouchon en caoutchouc inclus dans un dispositif de pulvérisation composé de polypropylène et dacier inoxydable. Aucun dispositif supplémentaire nest nécessaire à son utilisation.
Présentations :
Une boîte comprenant 1 emballage plastique contenant 2 récipients unidoses de 0,1 mL de solution pour pulvérisation nasale.
Une boîte comprenant 10 emballages plastiques contenant chacun 2 récipients unidoses de 0,1 mL de solution pour pulvérisation nasale.
Une boîte comprenant 6 plaquettes contenant chacune 1 récipient unidose de 0,1 mL de solution pour pulvérisation nasale.
Titulaire de lautorisation de mise sur le marché <
KARIHAUGVEIEN 22
NO-1086 OSLO
NORVEGE
Exploitant de lautorisation de mise sur le marché <
LABORATOIRE CEVIDRA
45 BOULEVARD MARCEL PAGNOL
06130 GRASSE
KARIHAUGVEIEN 22
NO-1086 OSLO
NORVEGE
Noms du médicament dans les Etats membres de l'Espace Economique Européen <
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : <
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de lANSM (France).
Les informations en vigueur les plus récentes [notice, guide rapide dutilisation et vidéo] sur ce médicament sont disponibles en scannant le QR code présent sur cette notice et sur lemballage extérieur avec un téléphone/appareil. Les mêmes informations sont disponibles à ladresse URL suivante : www.ventizolve.com et sur le site Internet de lANSM.

Les informations suivantes sont destinées aux témoins uniquement :
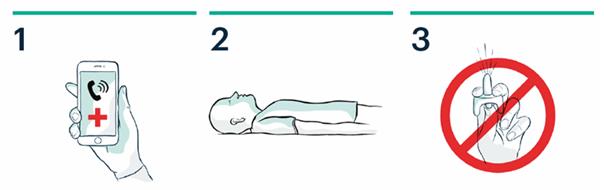
1. Appelez le 15 ou le 112
2. Allongez le patient sur le dos. Dégagez les voies respiratoires.
3. Ne pas amorcer ou tester le pulvérisateur nasal.
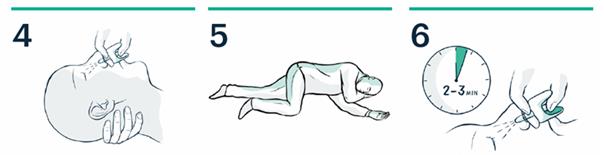
4. Soutenez la nuque. Placez le pulvérisateur dans une narine. Appuyez fermement sur le piston jusqu'à ce qu'il clique.
5. Placez le patient en position latérale de sécurité. Restez avec lui jusquà larrivée des services de secours.
6. Après 2 à 3 minutes, s'il n'y a pas d'amélioration, une deuxième dose doit être administrée dans lautre narine.