NOTICE
ANSM - Mis à jour le : 03/04/2024
DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique
Estradiol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique ?
3. Comment utiliser DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique ?
6. Contenu de lÂ’emballage et autres informations.
1. QUÂ’EST-CE QUE DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique ET DANS QUELS CAS EST-IL UTILISE ? <
Classe pharmacothérapeutique - code ATC : G03CA03.
DERMESTRIL SEPTEM est un traitement hormonal substitutif (THS). Il contient du 17-β estradiol. DERMESTRIL SEPTEM est utilisé chez les femmes ménopausées dont les dernières règles datent dÂ’au moins 6 mois.
DERMESTRIL SEPTEM est utilisé pour :
Soulager les symptômes apparaissant après la ménopause.
Lors de la ménopause, la quantité d’estrogènes produits par l’organisme féminin chute. Chez certaines femmes, cette chute se traduit par des symptômes tels qu’une sensation de chaleur au niveau du visage, du cou et de la poitrine (les « bouffées de chaleur »). DERMESTRIL SEPTEM soulage ces symptômes après la ménopause.
DERMESTRIL SEPTEM vous sera prescrit uniquement si vos symptômes altèrent gravement votre vie quotidienne.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DÂ’UTILISER DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique ? <
Antécédents médicaux et examens réguliers
L’utilisation d’un THS entraine des risques qui doivent être pris en considération lorsque vous décidez de commencer ce traitement ou de le continuer.
L’expérience chez les femmes avec une ménopause précoce (liée à une insuffisance ovarienne ou à une chirurgie) est limitée. Si vous avez une ménopause précoce, les risques liés à l’utilisation d’un THS peuvent être différents. Parlez-en à votre médecin.
Avant de commencer (ou recommencer) un THS, votre médecin vous interrogera sur vos antécédents médicaux personnels et familiaux. Votre médecin peut décider de pratiquer un examen physique. Cet examen peut inclure un examen de vos seins et, si nécessaire, un examen gynécologique.
Dès que vous commencez DERMESTRIL SEPTEM, consultez votre médecin pour des examens réguliers (au moins une fois par an). Lors de ces examens, celui-ci pourra aborder avec vous les bénéfices et les risques liés à la poursuite du traitement par DERMESTRIL SEPTEM.
Faites régulièrement une mammographie en suivant les recommandations de votre médecin.
NÂ’utilisez jamais DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique :
Si l’une des conditions suivantes s’applique à vous. Si vous avez des doutes sur un des points ci-dessous, parlez-en à votre médecin avant de prendre DERMESTRIL SEPTEM.
NÂ’utilisez jamais DERMESTRIL SEPTEM :
· Si vous avez ou avez eu un cancer du sein, ou s’il existe une suspicion que vous en ayez un ;
· Si vous avez un cancer sensible aux estrogènes tel qu’un cancer de la paroi de l’utérus (endomètre), ou s’il existe une suspicion que vous en ayez un ;
· Si vous avez des saignements vaginaux non expliqués ;
· Si vous avez un développement exagéré de la paroi de l’utérus (hyperplasie de l’endomètre) qui n’est pas traité ;
· Si vous avez ou avez eu un caillot sanguin dans une veine (thrombose) tel que dans les jambes (thrombose veineuse profonde), ou dans les poumons (embolie pulmonaire) ;
· Si vous avez des troubles de la coagulation sanguine (tels qu’un déficit en protéine C, protéine S ou antithrombine) ;
· Si vous avez ou avez eu récemment une maladie causée par des caillots sanguins dans les artères, telle qu’une crise cardiaque, un accident vasculaire cérébral, ou de l’angine de poitrine ;
· Si vous avez ou avez eu une maladie du foie, et que vos tests de la fonction hépatique ne sont pas retournés à la normale ;
· Si vous avez un trouble rare du sang appelé « porphyrie » qui est transmis par votre famille (maladie héréditaire) ;
· Si vous êtes allergique (hypersensible) à l’estradiol ou à l’un des excipients de DERMESTRIL SEPTEM (listés en rubrique 6 « Contenu de l’emballage et autres informations »).
Si l’une de ces pathologies apparaît pour la première fois lors du traitement avec DERMESTRIL SEPTEM, arrêtez le traitement et consultez immédiatement votre médecin.
Avertissements et précautions
Mises en garde et précautions d’emploi
Signalez à votre médecin avant de débuter votre traitement, si vous avez déjà eu un des signes suivants car ils peuvent revenir ou s’aggraver pendant le traitement par DERMESTRIL SEPTEM. Si c’est le cas, consultez votre médecin pour des examens plus réguliers :
· fibromes dans votre utérus ;
· présence de muqueuse utérine en dehors de l'utérus (endométriose) ou antécédents de développement exagéré de votre muqueuse utérine (hyperplasie endométriale) ;
· risque augmenté de développer des caillots sanguins (voir « Caillots de sang dans une veine (thromboses) ») ;
· risque augmenté d’avoir un cancer dépendant des estrogènes (par exemple si votre mère, votre sœur ou votre grand-mère a eu un cancer du sein) ;
· hypertension artérielle ;
· maladie du foie, telle qu’une tumeur bénigne du foie ;
· diabète ;
· calcul biliaire ;
· migraine ou maux de tête sévères ;
· maladie du système immunitaire qui peut affecter plusieurs parties du corps (lupus érythémateux disséminé, LED) ;
· épilepsie ;
· asthme ;
· maladie affectant les tympans ou l’audition (otosclérose) ;
· niveau élevé de graisses dans votre sang (triglycérides) ;
· rétention d’eau liée à des troubles cardiaques ou rénaux ;
· angioœdème héréditaire ou acquis.
Arrêtez votre traitement et prévenez immédiatement votre médecin :
· Si vous notez l’apparition des signes suivants :
o une des pathologies signalées en rubrique « N’utilisez jamais DERMESTRIL SEPTEM » ;
o un jaunissement de votre peau ou du blanc de vos yeux. C’est peut-être un signe d’une maladie du foie ;
o un gonflement du visage, de la langue et/ou de la gorge, et/ou des difficultés à déglutir ou une urticaire accompagnée de difficultés à respirer qui suggèrent un angioœdème ;
o une augmentation importante de votre pression artérielle (les symptômes peuvent être mal de tête, fatigue, sensations vertigineuses) ;
o des maux de tête tels qu’une migraine, qui apparaissent pour la première fois ;
o si vous devenez enceinte ;
o si vous remarquez des signes possibles dÂ’un caillot sanguin, tels que :
§ o gonflement douloureux dans vos jambes,
§ o douleur brutale à la poitrine,
§ o difficulté à respirer.
Pour plus d’information, voir rubrique « Caillots de sang dans une veine ».
Note : DERMESTRIL SEPTEM n’est pas un contraceptif. S’il s’est écoulé moins d’un an depuis vos dernières règles, ou si vous avez moins de 50 ans, vous pouvez avoir besoin d’une contraception complémentaire pour éviter une grossesse. Demandez conseil à votre médecin.
THS et cancer
Développement exagéré de la muqueuse utérine (hyperplasie endométriale) et cancer de la paroi de l’utérus (cancer de l’endomètre)
La prise d’un THS à base d’estrogène seul augmentera le risque de développement exagéré de la muqueuse utérine (hyperplasie endométriale) et de cancer de la muqueuse utérine (cancer de l’endomètre).
La prise d’un progestatif en plus de l'estrogène pendant au moins 12 jours par cycle de 28 jours vous protège de ce risque supplémentaire. Si vous avez toujours votre utérus, votre médecin vous prescrira donc un progestatif à prendre séparément. Si vous n’avez plus votre utérus (si vous avez eu une hystérectomie), votre médecin vous dira si vous pouvez prendre ce médicament en toute sécurité sans y associer un progestatif.
Si l’on considère les femmes qui ont encore leur utérus et qui ne prennent pas de THS, en moyenne, 5 femmes sur 1000 se verront diagnostiquer un cancer de l'endomètre entre 50 et 65 ans. Pour les femmes âgées de 50 à 65 ans qui ont encore un utérus et qui prennent un estrogène seul, entre 10 et 60 femmes sur 1000 se verront diagnostiquer un cancer de l'endomètre (soit 5 à 55 cas supplémentaires), en fonction de la dose et de la durée d’utilisation.
Saignements irréguliers
Lors d’un traitement avec DERMESTRIL SEPTEM, vous aurez des saignements une fois par mois (appelés saignements de privation). Mais vous pouvez aussi avoir des saignements irréguliers ou des petites pertes sanguines (spotting), en plus des saignements mensuels. Si ces saignements irréguliers :
· persistent au-delà des 6 premiers mois,
· débutent alors que vous prenez DERMESTRIL SEPTEM depuis plus de 6 mois,
· persistent après l’arrêt du traitement par DERMESTRIL SEPTEM,
Consultez votre médecin dès que possible.
Cancer du sein
Les données disponibles montrent que la prise d’un THS estro-progestatif combiné ou d’un traitement hormonal de substitution (THS) à base d'estrogènes seuls augmente le risque de cancer du sein. Ce risque supplémentaire dépend de la durée de suivi du THS. Le risque additionnel devient évident au bout de 3 ans d’utilisation. Après avoir arrêté le THS, le risque additionnel diminuera dans le temps, mais pourra perdurer 10 ans ou plus si vous avez suivi un THS pendant plus de 5 ans.
Pour comparaison
Chez les femmes de 50 à 54 ans qui ne prennent pas de THS, un diagnostic de cancer du sein sera posé, en moyenne, chez environ 13 à 17 femmes sur 1 000 après une période de cinq ans.
Chez les femmes âgées de 50 ans qui débutent un THS à base d'estrogènes seuls pour 5 ans, on dénombrera 16 à 17 cas sur 1 000 utilisatrices (soit 0 à 3 cas supplémentaires).
Chez les femmes âgées de 50 qui débutent un THS estro-progestatif pour 5 ans, on dénombrera 21 cas sur 1 000 utilisatrices (soit 4 à 8 cas supplémentaires).
Chez les femmes de 50 à 59 ans qui ne prennent pas de THS, un diagnostic de cancer du sein sera posé, en moyenne, chez environ 27 femmes sur 1 000 après une période de dix ans.
Chez les femmes âgées de 50 ans qui débutent un THS à base d'estrogènes seuls pour 10 ans, on dénombrera 34 cas sur 1 000 utilisatrices (soit 7 cas supplémentaires).
Chez les femmes âgées de 50 ans qui débutent un THS estro-progestatif pour 10 ans, on dénombrera 48 cas sur 1 000 utilisatrices (soit 21 cas supplémentaires).
Vérifiez régulièrement vos seins. Consultez votre médecin si vous remarquez des changements tels que :
· capitons au niveau de la peau,
· modifications au niveau du mamelon,
· boules éventuelles que vous pouvez voir ou sentir.
De plus, il est conseillé de participer aux programmes de dépistage par mammographie, lorsqu’ils vous sont proposés. Pour la mammographie de dépistage, il est important d’informer le professionnel de santé (manipulateur en radiologie/médecin) qui vous fait la radiographie que vous utilisez un THS, car ce médicament peut augmenter la densité de vos seins, ce qui peut affecter les résultats de la mammographie. Lorsque la densité de la poitrine est augmentée, la mammographie peut ne pas détecter toutes les masses (boules).
Cancer de lÂ’ovaire
Le cancer de l’ovaire est rare, beaucoup plus rare que le cancer du sein. L'utilisation d’estrogène seul ou d’une combinaison THS œstro–progestative a été associée à un risque légèrement accru du cancer des ovaires.
Le risque du cancer des ovaires varie avec l'âge. Par exemple, chez des femmes de 50 à 54 ans qui ne prennent pas de THS, environ 2 femmes sur 2000 développeront un cancer des ovaires au cours d'une période de 5 ans. Pour les femmes prenant pendant une période de 5 ans un THS, il y aura environ 3 cas sur 2000 utilisatrices (c'est-à -dire environ 1 cas supplémentaire).
Effets des THS sur le cÂœur et la circulation
Caillots de sang dans une veine (thrombose veineuse)
Le risque de caillots sanguins dans les veines est environ de 1,3 à 3 fois supérieur chez les utilisatrices de THS par rapport aux non-utilisatrices, particulièrement pendant la première année de prise.
Ces caillots de sang peuvent être graves, et si l'un d’eux migre vers les poumons, cela peut causer des douleurs dans la poitrine, un essoufflement, un malaise, voire parfois le décès.
Vous avez plus de risque d’avoir un caillot sanguin, lorsque vous vieillissez, et si l’une des situations suivantes s’applique à vous. Signalez à votre médecin si l'une de ces situations s'applique à vous :
· vous ne pouvez pas marcher pendant une longue période en raison d’une chirurgie, blessure ou maladie grave (voir également section 3 « Si vous devez subir une opération chirurgicale »),
· vous êtes en surpoids sévère (IMC > 30 kg/m²),
· vous avez des problèmes de coagulation sanguine qui nécessitent un traitement à long terme avec un médicament utilisé pour prévenir les caillots sanguins,
· un de vos parents proches a déjà eu un caillot de sang dans la jambe, le poumon ou un autre organe,
· vous avez un lupus érythémateux disséminé (LED),
· vous avez un cancer.
Pour les signes de caillot sanguin, voir rubrique « Arrêtez votre traitement et prévenez immédiatement votre médecin ».
Comparaison
Chez les femmes de la cinquantaine ne prenant pas de THS, un caillot sanguin veineux survient en moyenne chez 4 à 7 femmes sur 1000 après une période de 5 ans.
Chez les femmes de la cinquantaine prenant un THS estro-progestatif au cours d’une période de 5 ans, il y aura 9 à 12 cas sur 1000 utilisatrices (c'est-à -dire 5 cas supplémentaires).
Chez les femmes de la cinquantaine qui n’ont plus leur utérus et qui ont pris un THS contenant uniquement un estrogène pendant plus de 5 ans, il y aura 5 à 8 cas sur 1000 utilisatrices (c’est-à -dire un cas supplémentaire).
Maladie cardiaque (crise cardiaque)
Il n’y a pas de preuves que le THS participe à la prévention d’une crise cardiaque.
Les femmes de plus de 60 ans utilisatrices de THS estro-progestatif ont un risque légèrement plus augmenté de développer une maladie cardiaque que celles qui ne prennent pas de THS.
Pour les femmes qui n’ont plus leur utérus et qui prennent un THS contenant uniquement un estrogène, le risque de développer une maladie cardiaque n’est pas augmenté.
Accident vasculaire cérébral (AVC)
Le risque d’avoir un accident vasculaire cérébral est environ 1,5 fois supérieur chez les utilisatrices de THS par rapport aux non-utilisatrices. Le nombre de cas supplémentaires d'AVC liés à l’utilisation d’un THS augmente avec l’âge.
Comparaison
Chez les femmes de la cinquantaine ne prenant pas de THS, un AVC est attendu en moyenne chez 8 femmes sur 1000 sur une période de plus de 5 ans. Pour les femmes de la cinquantaine prenant un THS, il y aura 11 cas sur 1000 utilisatrices sur une période de plus de 5 ans (c'est-à -dire 3 cas supplémentaires).
Autres pathologies
Le THS ne prévient pas la perte de mémoire. Le risque de perte de mémoire pourrait être toutefois plus élevé chez les femmes qui commencent à utiliser un THS après l’âge de 65 ans. Demandez conseil à votre médecin.
Enfants et adolescents
Sans objet.
Autres médicaments et DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique
Certains médicaments peuvent interférer avec les effets de DERMESTRIL SEPTEM. Cette interférence peut entraîner des saignements irréguliers. Cela concerne les médicaments suivants :
· les médicaments utilisés dans le traitement de l'épilepsie (par exemple phénobarbital, phénytoïne, carbamazépine),
· les médicaments utilisés dans le traitement de la tuberculose (par exemple rifampicine et rifabutine),
· les médicaments utilisés dans le traitement des infections par le VIH (par exemple névirapine, éfavirenz, ritonavir et nelfinavir),
· les préparations à base de plantes contenant du millepertuis (Hypericum perforatum).
Le THS peut modifier le mode d'action de certains autres médicaments :
· un médicament contre l'épilepsie (lamotrigine), car il pourrait augmenter la fréquence des crises,
· les médicaments utilisés dans le traitement de l’infection par le virus de l’hépatite C (VHC) (tels que l’association ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, et le glécaprévir/pibrentasvir), qui peuvent entraîner une augmentation de certains paramètres du fonctionnement du foie (augmentation du taux d’ALAT, une enzyme du foie) chez les femmes utilisant des contraceptifs contenant de l’éthinylestradiol. DERMESTRIL SEPTEM contient de l’estradiol à la place de l’éthinylestradiol. On ne sait pas si une augmentation du taux d’ALAT peut se produire lors de l’utilisation de DERMESTRIL SEPTEM avec cette association contre le VHC.
Veuillez informer votre médecin ou votre pharmacien si vous prenez ou avez récemment pris d’autres médicaments incluant des médicaments obtenus sans ordonnance, des médicaments à base de plantes ou d’autres produits naturels.. Votre médecin vous conseillera.
Analyses en laboratoire
Si vous devez faire une prise de sang, signalez à votre médecin ou au personnel du laboratoire d’analyse que vous prenez DERMESTRIL SEPTEM, car ce médicament peut modifier les résultats de certaines analyses.
DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
DERMESTRIL SEPTEM doit être uniquement utilisé chez les femmes ménopausées. Si vous devenez enceinte, interrompez le traitement par DERMESTRIL SEPTEM et parlez-en à votre médecin.
Conduite de véhicules et utilisation de machines
Il n'y a pas de données qui indiquent que DERMESTRIL SEPTEM peut avoir un effet sur l'aptitude à conduire un véhicule ou à utiliser des machines.
DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique contient
Sans objet.
3. COMMENT UTILISER DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique ? <
Trois dosages de DERMESTRIL SEPTEM sont disponibles : DERMESTRIL SEPTEM 25, 50 et 75.
Votre médecin choisira le dispositif DERMESTRIL SEPTEM le mieux adapté à votre cas, bien que la plupart des femmes commencent par le dispositif DERMESTRIL SEPTEM 25. Pendant le traitement, votre médecin adaptera la dose du dispositif à votre situation personnelle, c’est à dire en fonction de l’efficacité du traitement et si vous souffrez de certains effets indésirables. En traitement d’attaque et d’entretien, votre médecin choisira la plus faible dose de dispositif efficace, pendant la durée la plus courte possible.
Des saignements et des taches de sang (spotting) peuvent apparaître pendant les premiers mois de traitement. Si le saignement ou les spottings apparaissent en cours de traitement, ou continuent après arrêt du traitement, veuillez contacter votre médecin.
Comment appliquer le dispositif ?
Vous devez appliquer le dispositif sur une peau propre et sèche, à un endroit ne présentant pas de coupures, de boutons ou de taches et non recouvert de crème, d’hydratant ou de talc.
Vous ne DEVEZ PAS appliquer les dispositifs DERMESTRIL SEPTEM sur ou à proximité des seins.
Votre dispositif DERMESTRIL SEPTEM doit être appliqué sur les hanches, les fesses ou le ventre (voir l’illustration 1).
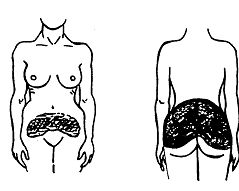
Illustration 1
Les zones en noir correspondent aux endroits où vous pouvez appliquer votre dispositif.
N’appliquez pas le dispositif sur une partie du corps formant des plis pendant les mouvements ou dans des zones où vos vêtements (par ex. ceintures élastiques) peuvent faire tomber le dispositif.
N’appliquez pas les dispositifs toujours au même endroit.
Un dispositif DERMESTRIL SEPTEM doit être appliqué sur la peau dès qu’il a été retiré de son sachet, comme suit :
(i) Déchirez le sachet au niveau du bord prédécoupé pour l’ouvrir. N’utilisez pas de ciseaux (voir l’illustration 2).
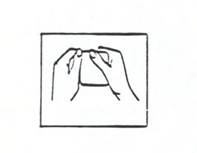
Illustration 2
(ii) Tenez le dispositif entre le pouce et l’index, au niveau de la petite surface constituée par la languette pré-détachable (voir l’illustration 3).
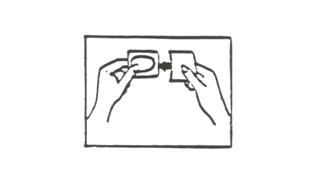
Illustration 3
(iii) Retirez la partie la plus grande du film protecteur de l’autre main (voir l’illustration 4). Ne touchez pas la face adhésive du dispositif avec les doigts sinon il n’adhèrera pas correctement.
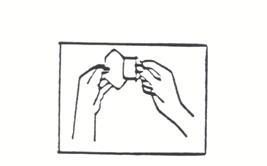
Illustration 4
(iv) Appliquez la partie ouverte du dispositif sur votre peau et retirez l’autre partie du film protecteur. Appuyez fermement sur toute la surface du dispositif pendant 10 secondes environ. Passez le doigt le long des bords pour vous assurer qu’il est bien collé.
Fréquence de remplacement du dispositif
Ce dispositif contient suffisamment d’hormone pour durer plusieurs jours. Afin de garantir une administration constante d’hormone, le dispositif doit être remplacé toutes les semaines ; ainsi chaque dispositif utilisé doit être retiré après sept jours et remplacé par un nouveau. Le dispositif peut être appliqué à n’importe quel moment de la journée.
Que faire si le dispositif se détache ?
Si DERMESTRIL SEPTEM est appliqué correctement, il est peu probable que le dispositif tombe. Cependant, s’il tombe, remplacez-le par un autre, puis rechangez le dispositif comme d’habitude, le jour suivant normalement prévu.
Votre dispositif doit rester fixé lorsque vous prenez une douche ou un bain, mais il risque de tomber si vous faites une séance de sauna ou que vous prenez un bain très chaud.
Comment enlever le dispositif transdermique ?
Pour retirer le dispositif, il suffit de décoller le bord et de tirer doucement sur le dispositif jusqu’à ce qu’il se détache. Après utilisation, pliez le dispositif en deux, la partie collante vers l’intérieur, puis jetez-le dans une poubelle inaccessible aux enfants.
Quand débuter le traitement ?
Vous pouvez commencer le traitement par DERMESTRIL SEPTEM à tout moment qui vous convient si vous n’êtes pas sous traitement à base d’estrogènes.
Si vous êtes sous traitement estro-progestatif cyclique ou séquentiel, vous devez terminer votre cycle de traitement en cours avant de débuter le traitement par DERMESTRIL SEPTEM. Le moment approprié pour commencer le traitement par DERMESTRIL SEPTEM est le premier jour des saignements de privation.
Si vous êtes déjà sous traitement estro-progestatif continu, vous pouvez passer à DERMESTRIL SEPTEM directement.
Comment prendre le progestatif avec DERMESTRIL SEPTEM ?
Si vous avez toujours votre utérus (si vous n’avez pas subi d’hystérectomie), votre médecin vous prescrira probablement un progestatif en plus du dispositif DERMESTRIL SEPTEM, pour éviter tout problème dû à un épaississement de la paroi de l’utérus, c’est-à -dire une hyperplasie de l’endomètre (voir les mises en garde spéciales concernant le cancer de l’endomètre). Votre médecin vous prescrira généralement le progestatif pendant 12 à 14 jours de chaque cycle de 28 jours. Vous aurez probablement des « saignements de privation » (ressemblant aux règles) pendant les derniers jours du traitement par progestatif, voire après l’arrêt.
Si vous avez utilisé plus de DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique que vous n'auriez dû :
Si vous avez accidentellement appliqué trop de dispositifs, vous pourrez ressentir une sensation de douleur au niveau des seins et/ou des saignements vaginaux, une irritabilité, une anxiété, des nausées, des vomissements, une somnolence, des sensations vertigineuses, un gonflement au niveau de l’abdomen ou du bassin, des flatulences, une rétention d’eau et une sensation de lourdeur au niveau des jambes. Ces signes disparaissent lorsque le traitement est arrêté.
Les informations ci-dessus sÂ’appliquent aussi en cas de surdosage chez lÂ’enfant.
Si vous oubliez d'utiliser DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique :
Si vous n'avez pas de traitement plusieurs jours de suite, des saignements irréguliers et des spottings peuvent survenir.
Si vous arrêtez d'utiliser DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique :
A l'arrêt du traitement par DERMESTRIL SEPTEM, les signes de déficit en estrogènes liés à la ménopause peuvent réapparaître.
Si vous avez besoin dÂ’avoir une intervention chirurgicale :
Si vous avez besoin d’avoir une intervention chirurgicale, prévenez le chirurgien que vous utilisez DERMESTRIL SEPTEM. Vous devrez peut-être arrêter d’utiliser DERMESTRIL SEPTEM 4 à 6 semaines avant l’opération pour réduire le risque de caillot sanguin (voir rubrique 2, « Caillots de sang dans une veine »). Demandez à votre médecin à quel moment vous pourrez reprendre le traitement par DERMESTRIL SEPTEM.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? <
Les pathologies suivantes ont été rapportées plus souvent chez les utilisatrices de THS par rapport aux non-utilisatrices :
· cancer du sein,
· épaississement anormal ou cancer de la paroi de l’utérus (hyperplasie endométriale ou cancer),
· cancer de l’ovaire,
· caillots sanguins dans les veines des jambes ou des poumons (thrombo-embolie veineuse),
· maladie cardiaque,
· accident vasculaire cérébral,
· probable perte de mémoire si le THS est commencé après l’âge de 65 ans.
Pour plus d’informations sur ces effets indésirables, voir rubrique 2.
Les effets indésirables suivants ont été rapportés avec un THS :
Effets indésirables fréquents (pouvant affecter jusqu’à 1 patiente sur 10) :
· céphalées,
· nausées,
· douleurs abdominales,
· troubles des règles (métrorragie), saignements vaginaux/utérins incluant des légers saignements (spotting),
· modifications du poids,
· éruption (peau rouge et enflammée),
· prurit (démangeaisons).
Effets indésirables peu fréquents (pouvant affecter jusqu’à 1 patiente sur 100) :
· muguet au niveau du vagin,
· sensations vertigineuses,
· réactions d’hypersensibilité,
· humeur dépressive,
· troubles visuels (altération de la vision),
· palpitations (rythme cardiaque irrégulier),
· dyspepsie (difficulté à digérer ou altération de la digestion),
· troubles de la vésicule biliaire,
· érythème noueux (nodules rouges douloureux sous la peau),
· urticaire,
· douleur mammaire, tension mammaire,
· œdème (quantité importante anormale de liquide dans le système circulatoire ou dans les tissus).
Effets indésirables rares (pouvant affecter jusqu’à 1 patiente sur 1000) :
· modification de la libido,
· irritation des yeux en cas de port de lentilles de contact,
· anxiété,
· migraine,
· ballonnement (plénitude ou gonflement abdominal post-prandial),
· vomissements,
· hirsutisme (croissance excessive des poils corporels ou sur le visage),
· acné (boutons sur le visage, la poitrine et le dos),
· crampes musculaires,
· dysménorrhée (crampes douloureuses pendant les menstruations),
· écoulement vaginal,
· syndrome de type prémenstruel (symptômes physiques présents entre l’ovulation et le début de la menstruation tels que tension mammaire, mal de dos, crampes abdominales, maux de tête, et modifications de l’appétit, ainsi que des symptômes psychologiques de l’anxiété, de la dépression et de l’agitation),
· hypertrophie mammaire,
· fatigue (épuisement physique et/ou moral).
· cancer du sein, tumeurs malignes ou bénignes pouvant être affectées par les taux d’estrogènes, comme le cancer de la muqueuse utérine (cancer de l’endomètre), cancer de l’ovaire, augmentation de la taille d’un léiomyome (tumeur bénigne de l’utérus),
· aggravation des crises d’épilepsie, contractions musculaires involontaires (chorée),
· accident vasculaire cérébral,
· caillots sanguins dans les artères (thromboembolisme artériel), angine de poitrine et crise cardiaque,
· caillots sanguins dans les jambes ou les poumons (thromboembolisme veineux ou embolie pulmonaire),
· inflammation du pancréas (pancréatite) chez les femmes présentant des taux importants de certaines graisses dans le sang (hypertriglycéridémie),
· reflux gastroœsophagien,
· troubles de la fonction hépatique pouvant s’accompagner d’un jaunissement de la peau (jaunisse),
· gonflement du visage et de la gorge pouvant entraîner des difficultés à respirer (angioœdème),
· éruption avec des lésions rouges en forme de cibles ou des plaies (érythème polymorphe),
· purpura vasculaire (inflammation de vaisseaux sanguins qui entraîne l'apparition de taches violacées sur la peau),
· décoloration de la peau notamment du visage ou du cou, connue sous le nom de « taches de grossesse » (chloasma),
· réactions au site d’application : rougeurs de la peau avec ou sans démangeaisons,
· incontinence urinaire,
· douleur des seins et tissus mammaires grumeleux (maladie fibrokystique du sein).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique ? <
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver dans les sachets fermés et à une température ne dépassant pas 25 °C.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte ou sur le sachet après EXP. La date d'expiration fait référence au dernier jour de ce mois.
Après utilisation, pliez le dispositif en deux, la partie collante vers l’intérieur, puis jetez-le dans une poubelle inaccessible aux enfants.
Ne jetez aucun médicament au tout-à -l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE LÂ’EMBALLAGE ET AUTRES INFORMATIONS <
Ce que contient DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique <
Les dispositifs DEMESTRIL SEPTEM contiennent lÂ’hormone estrogénique 17-β estradiol. Les dispositifs adhésifs sont appliqués sur la peau et lÂ’hormone pourra passer ainsi de façon continue à travers votre peau et dans votre corps.
Les dispositifs DEMESTRIL SEPTEM sont uniquement à usage externe.
DERMESTRIL SEPTEM 50 microgrammes/24 heures contient 5 mg de substance active estradiol sous forme hémihydratée et libère environ 50 microgrammes d’estradiol par jour (sur 24 heures).
Les autres composants sont : matrice adhésive (copolymères acryliques), film de support (polyéthylène téréphtalate) et feuillet de protection (polyéthylène téréphtalate siliconé) qui doit être retiré avant utilisation.
Qu’est-ce que DERMESTRIL SEPTEM 50 microgrammes/24 heures, dispositif transdermique et contenu de l’emballage extérieur <
DEMESTRIL SEPTEM se présente sous forme d'un dispositif transdermique transparent dans un sachet de protection individuel scellé. Boîte de 4 ou de 12 dipositifs dans un étui carton.
Titulaire de l’autorisation de mise sur le marché <
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché <
VIATRIS SANTE
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
BENZSTRASSE 1
61352 BAD HOMBURG
ALLEMAGNE
ou
LTS LOHMANN THERAPIE-SYSTEME AG
LOHMANNSTR. 2
56626 ANDERNACH
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen <
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : <
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).