NOTICE
ANSM - Mis à jour le : 22/06/2023
VIZITRAV 40 microgrammes/mL, collyre en solution
Travoprost
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que VIZITRAV 40 microgrammes/mL, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VIZITRAV 40 microgrammes/mL, collyre en solution ?
3. Comment utiliser VIZITRAV 40 microgrammes/mL, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VIZITRAV 40 microgrammes/mL, collyre en solution ?
6. Contenu de lÂ’emballage et autres informations.
1. QUÂ’EST-CE QUE VIZITRAV 40 microgrammes/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ? <
VIZITRAV 40 microgrammes/mL, collyre en solution contient du travoprost, qui fait partie d’un groupe de médicaments appelé analogues des prostaglandines. Il agit en baissant la pression dans l’œil. Il peut être utilisé seul ou en association avec d’autres collyres comme les bêta-bloquants, qui réduisent aussi la pression oculaire.
VIZITRAV 40 microgrammes/mL, collyre en solution est utilisé pour réduire une pression élevée à l’intérieur de l’œil chez l’adulte, les adolescents et les enfants âgés de 2 mois et plus. Cette pression peut conduire à une maladie appelée glaucome.
VIZITRAV 40 microgrammes/mL, collyre en solution est une solution stérile qui ne contient pas de conservateur.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DÂ’UTILISER VIZITRAV 40 microgrammes/mL, collyre en solution ? <
NÂ’utilisez jamais VIZITRAV 40 microgrammes/mL, collyre en solution :
· si vous êtes allergique (hypersensible) à travoprost ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Si c’est le cas, vous devez vous adresser à votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser VIZITRAV 40 microgrammes/mL, collyre en solution.
· VIZITRAV 40 microgrammes/mL, collyre en solution peut augmenter la longueur, l’épaisseur, la couleur et/ou le nombre de vos cils. Des modifications au niveau des paupières, y compris une pilosité ciliaire anormale et des anomalies au niveau des tissus autour de l’œil, ont aussi été observées.
· VIZITRAV 40 microgrammes/mL, collyre en solution peut modifier la couleur de votre iris (partie colorée de votre œil). Ce changement peut être permanent. Une modification de la couleur de la peau autour de l’œil peut aussi se produire.
· Si vous avez eu une chirurgie de la cataracte, parlez-en à votre médecin avant d’utiliser VIZITRAV 40 microgrammes/mL, collyre en solution.
· Si vous avez ou avez déjà eu une inflammation de l’œil (iritis ou uvéite), parlez-en à votre médecin avant d’utiliser VIZITRAV 40 microgrammes/mL, collyre en solution.
· VIZITRAV 40 microgrammes/mL, collyre en solution peut, à de rares occasions, provoquer des essoufflements ou une respiration sifflante ou augmenter les symptômes d'asthme. Si vous observez des changements dans votre manière de respirer lorsque vous utilisez VIZITRAV 40 microgrammes/mL, collyre en solution, prévenez immédiatement votre médecin.
· Le travoprost peut être absorbé par la peau. Si ce médicament vient en contact avec la peau, il doit être enlevé aussitôt par lavage. Ceci est particulièrement important pour les femmes enceintes ou souhaitant le devenir.
· Si vous êtes porteur de lentilles de contact souples, n’utilisez pas le collyre lorsque vous portez vos lentilles. Après avoir utilisé le collyre, attendez 15 minutes avant de remettre vos lentilles.
Enfants et adolescents
VIZITRAV 40 microgrammes/mL, collyre en solution peut être utilisé chez les enfants de 2 mois à moins de 18 ans, à la même posologie que chez l’adulte. L’utilisation du VIZITRAV 40 microgrammes/mL, collyre en solution n’est pas recommandée pour les enfants âgés de moins de 2 mois.
Autres médicaments et VIZITRAV 40 microgrammes/mL, collyre en solution
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
VIZITRAV 40 microgrammes/mL, collyre en solution avec des aliments
Sans objet.
Grossesse, allaitement et fertilité
N’utilisez pas VIZITRAV 40 microgrammes/mL, collyre en solution si vous êtes enceinte. Si vous pensez être enceinte, parlez-en à votre médecin aussitôt. Si vous pouvez être enceinte, utilisez un moyen de contraception adéquat pendant l’utilisation de VIZITRAV 40 microgrammes/mL, collyre en solution.
NÂ’utilisez pas VIZITRAV 40 microgrammes/mL, collyre en solution si vous allaitez. VIZITRAV 40 microgrammes/mL, collyre en solution peut passer dans votre lait.
Demandez conseil à votre médecin avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Vous pouvez trouver que votre vision est trouble juste après avoir utilisé VIZITRAV 40 microgrammes/mL, collyre en solution. Ne conduisez pas de voiture et n’utilisez pas de machines avant que cet effet ait disparu.
VIZITRAV 40 microgrammes/mL, collyre en solution contient de l’hydroxystéarate de macrogolglycérol 40
Ce médicament contient de l’hydroxystéarate de macrogolglycérol 40 qui peut induire des réactions cutanées locales.
3. COMMENT UTILISER VIZITRAV 40 microgrammes/mL, collyre en solution ? <
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou du médecin traitant votre enfant ou de votre pharmacien. Vous devez vérifier auprès de votre médecin, médecin traitant votre enfant ou votre pharmacien en cas de doute.
La dose recommandée est une goutte dans l’œil ou les yeux atteints, une fois par jour - le soir.
Utilisez VIZITRAV 40 microgrammes/mL, collyre en solution dans les deux yeux uniquement si votre médecin vous a dit de le faire.
Utilisez-le aussi longtemps que votre médecin ou le médecin traitant de votre enfant vous l’a dit.
NÂ’utilisez VIZITRAV 40 microgrammes/mL, collyre en solution que pour lÂ’instiller dans votre Âœil/vos yeux ou celui/ceux de votre enfant.
Mode dÂ’Utilisation
|
1a
1b
|
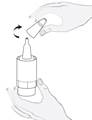
· Sortez le flacon multidose du carton (figure 1a) et inscrivez la date d’ouverture sur la boîte en carton et sur le flacon dans l’espace prévu à cet effet. · Prenez le flacon de médicament et un miroir · Lavez-vous les mains. · Enlevez le bouchon (figure 1b). |
|
2
|
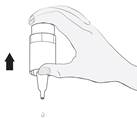
· Tenez le flacon à l’envers, avec le pouce sur le rebord du flacon et les autres doigts sur le fond du flacon. · Avant la première utilisation, pompez le flacon de façon répétée 15 fois (figure 2). Un éventuel aspect blanchâtre des gouttes ne doit pas être préoccupant. |
|
3
|
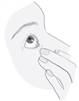
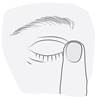
· Penchez votre tête ou celle de votre enfant en arrière. Avec un doigt propre, abaissez délicatement la paupière de façon à former une petite poche entre la paupière et l’œil. La goutte sera déposée à cet endroit (figure3). · Rapprochez l’embout du flacon de l’œil. Utilisez le miroir pour vous aider ; |
|
4
5
|
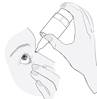
· Ne touchez pas l’œil, les paupières, les zones voisines ou d’autres surfaces avec le compte-gouttes. Cela peut contaminer le collyre. · Appuyez légèrement sur le bas du flacon pour libérer une goutte du médicament à la fois (figure 4). · Si une goutte tombe à côté de l’œil, recommencez. · Après avoir utilisé le médicament, comprimez avec un doigt l’angle interne de l’œil, près du nez (figure 5). Ceci permet d’empêcher le médicament d’aller dans le reste du corps |
|
|
· Si vous devez traiter les deux yeux, recommencez ces mêmes étapes pour l’autre œil. · Refermez bien le flacon multidose immédiatement après usage. · Utilisez un seul flacon de médicament à la fois. N’ouvrez pas le bouchon tant que vous n’avez pas besoin d’utiliser le flacon multidose. · Jetez le flacon 4 semaines après la première ouverture afin de prévenir toute contamination , et utilisez un nouveau flacon. |
Si vous (ou votre enfant) utilisez une autre préparation ophtalmique tels que collyre ou pommade ophtalmique :
Attendez au moins 5 minutes entre l’instillation de VIZITRAV 40 microgrammes/mL, collyre en solution et les autres préparations ophtalmiques.
Si vous (ou votre enfant) avez pris plus de VIZITRAV 40 microgrammes/mL, collyre en solution que vous n’auriez dû :
Rincez tout médicament de l’œil avec de l’eau tiède. Ne mettez pas d’autres gouttes jusqu’à ce que le moment soit venu de prendre la goutte suivante.
Si vous oubliez de prendre VIZITRAV 40 microgrammes/mL, collyre en solution :
Poursuivez le traitement à l’instillation suivante comme prévu. Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre. N’utilisez jamais plus d’une goutte par jour dans l’œil (les yeux) atteint(s).
Si vous arrêtez de prendre VIZITRAV 40 microgrammes/mL, collyre en solution :
N’arrêtez pas de prendre VIZITRAV 40 microgrammes/mL, collyre en solution sans en avoir préalablement parlé à votre médecin ou au médecin traitant votre enfant, la pression de votre œil ou de celle de l’œil de votre enfant n’étant pas contrôlée ce pourrait provoquer une perte de vue.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, au médecin traitant votre enfant ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? <
Vous pouvez généralement continuer à utiliser les gouttes, sauf si les effets sont graves. Si vous avez un doute, parlez-en à votre médecin ou votre pharmacien. N’arrêtez pas de prendre VIZITRAV 40 microgrammes/mL, collyre en solution sans en parler à votre médecin.
Les effets indésirables suivants ont été rapportés avec VIZITRAV 40 microgrammes/mL, collyre en solution.
Très fréquents (peut affecter plus de 1 personne sur 10)
Effets oculaires
· Rougeur oculaire
Fréquents (peut affecter jusqu’à 1 personne sur 10)
Effets oculaires
· changement de la couleur de l’iris (partie colorée de l’œil)
· douleur oculaire
· gêne oculaire
· œil sec
· démangeaisons oculaires
· irritations oculaires
Peu fréquents (peut affecter jusqu’à 1 personne sur 100)
Effets oculaires
· troubles de la cornée
· inflammation de l’œil
· inflammation de l’iris
· inflammation dans l’œil
· inflammation de la surface de l’œil avec ou sans lésion de surface
· sensibilité à la lumière
· écoulement de l’œil
· inflammation de la paupière
· rougeur de paupière
· gonflement autour de l’œil
· démangeaison de la paupière
· vision trouble
· augmentation de la production de larmes
· infection ou inflammation de la conjonctive (conjonctivite)
· renversement externe anormal de la paupière inférieure
· opacification de l’œil
· croûte sur le bord de la paupière
· croissance des cils
Effets secondaires généraux
· augmentation des symptômes allergiques
· mal de tête
· rythme cardiaque irrégulier
· toux
· nez bouché
· irritation de la gorge
· assombrissement de la peau autour des yeux
· assombrissement de la peau
· texture de cheveux anormale
· croissance capillaire excessive
Rares (peut affecter jusquÂ’Ã 1 personne sur 1 000)
Effets oculaires
· perception de flashs
· eczéma des paupières
· orientation anormale des cils qui se développent vers l’œil
· gonflement de l’œil
· acuité visuelle diminuée
· vision avec halo
· sensation oculaire diminuée
· inflammation des glandes des paupières
· pigmentation dans l’œil
· augmentation de la taille de la pupille
· épaississement des cils
· changement de la coloration des cils
· fatigue des yeux
Effets secondaires généraux
· infection oculaire virale
· sensation vertigineuse
· mauvais gout
· rythme cardiaque diminué ou irrégulier
· tension artérielle diminuée ou augmentée
· difficulté respiratoire
· asthme
· allergie nasale
· sécheresse nasale
· dysphonie
· inconfort gastro-intestinal ou ulcère
· constipation
· sécheresse buccale
· rougeur ou démangeaison de la peau
· éruption cutanée
· changement de la couleur des cheveux
· perte des cils
· douleurs articulaires
· douleurs musculo-squelettiques,
· fatigue généralisée
Indéterminée (la fréquence ne peut être estimée sur la base des données disponibles)
Effets oculaires
· inflammation de l’arrière de l’œil
· yeux apparaissent plus enfoncés
Effets secondaires généraux
· dépression
· anxiété
· insomnie
· sensation de faux mouvement
· acouphènes
· douleur thoracique
· fréquence cardiaque diminuée
· fréquence cardiaque augmentée
· aggravation de l’asthme
· diarrhées
· saignements de nez
· douleur abdominale
· nausée
· vomissement
· démangeaisons
· croissance capillaire anormale
· mictions involontaires ou douloureuses
· augmentation de l’antigène de la prostate
Effets indésirables supplémentaires chez les enfants et les adolescents
Chez les enfants et les adolescents, les effets indésirables le plus souvent observés avec VIZITRAV 40 microgrammes/mL, collyre en solution sont la rougeur de l’œil et la croissance des cils. Ces deux effets indésirables ont été observés avec une incidence plus élevée chez les enfants et les adolescents que chez les adultes.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VIZITRAV 40 microgrammes/mL, collyre en solution ? <
A conserver à une température ne dépassant pas 25°C.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et la boite après EXP. La date de péremption fait référence au dernier jour de ce mois.
Après première ouverture, ce médicament ne requiert pas de conditions particulières de conservation.
Jetez le flacon 4 semaines après l’avoir ouvert pour la première fois, pour prévenir les infections. Inscrivez la date à laquelle vous l’avez ouvert dans l’espace prévu à cet effet sur chaque étiquette du flacon et sur la boîte.
Ne jetez aucun médicament au tout-à -l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE LÂ’EMBALLAGE ET AUTRES INFORMATIONS <
Ce que contient VIZITRAV 40 microgrammes/mL, collyre en solution <
· La substance active est :
Travoprost..................................................................................................... 40 microgrammes
pour 1 mL de collyre en solution.
Chaque mL de solution contient 40 microgrammes de travoprost.
· Les autres composants sont :
Hydroxystéarate de macrogolglycérol 40, acide borique (E284), mannitol (E421), chlorure de sodium, propylène glycol (E1520), hydroxyde de sodium (ajustement du pH) et eau purifiée.
Qu’est-ce que VIZITRAV 40 microgrammes/mL, collyre en solution et contenu de l’emballage extérieur <
VIZITRAV 40 microgrammes/mL, collyre en solution se présente sous forme d’une solution aqueuse limpide, incolore de 2,5 mL dans un étui contenant un flacon multidose blanc de 5 mL (PP) équipé d’un système de pompe (PP ou PEHD ou PEBD), un cylindre orange de pressurisation et un bouchon (PEHD).
Ce médicament est disponible dans les présentations suivantes :
1 x 2,5 mL (1 flacon multidose de 2,5 mL)
3 x 2,5 mL (3 flacons multidose de 2,5 mL)
4 x 2,5 mL (4 flacons multidose de 2,5 mL)
Etui contenant 1, 3 ou 4 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché <
416, RUE SAMUEL MORSE – CS99535
34961 MONTPELLIER
Exploitant de l’autorisation de mise sur le marché <
LABORATOIRE CHAUVIN
416, RUE SAMUEL MORSE – CS99535
34961 MONTPELLIER
JADRAN-GALENSKI LABORATORIJ d. d.
SVILNO 20
RIJEKA 51000
CROATIE
OU
PHARMATHEN S.A.
DERVENAKION 6
PALLINI ATTIKIS 15351
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen <
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’Autorisation de Mise sur le Marché.
La dernière date à laquelle cette notice a été révisée est : <
[A compléter ultérieurement par le titulaire]
{Mois AAAA}
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).