NOTICE
ANSM - Mis à jour le : 13/10/2022
TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution
Travoprost/timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution ?
3. Comment utiliser TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution ?
6. Contenu de lÂ’emballage et autres informations.
1. QUÂ’EST-CE QUE TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution ET DANS QUELS CAS EST-IL UTILISE ? <
TRAVOPROST/TIMOLOL VIATRIS collyre est utilisé pour traiter une pression élevée à l’intérieur de l’oeil chez les adultes, incluant les personnes âgées. Cette pression peut conduire à une maladie appelée glaucome.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DÂ’UTILISER TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution ? <
NÂ’utilisez jamais TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/mL + 5 mg/mL, collyre en solution
· si vous êtes allergique au travoprost, au timolol, ou à l’un des autres composants de ce médicament (voir rubrique 6).
· si vous êtes allergique à d’autres prostaglandines ou bétabloquants.
· si vous souffrez ou avez souffert de troubles respiratoires tels que de l’asthme, une bronchite chronique obstructive sévère (une maladie pulmonaire sévère qui peut entraîner une respiration sifflante, une gêne respiratoire et/ou une toux persistante) ou d’autres types de problèmes respiratoires.
· si vous avez un rhume des foins sévère.
· si vous avez un rythme cardiaque lent, une insuffisance cardiaque ou des troubles du rythme cardiaque (battement irrégulier du cœur).
· si la surface de votre œil est trouble.
Demandez l’avis de votre médecin si vous êtes atteint par un de ces troubles.
Avertissements et précautions
Avant d’utiliser ce médicament, prévenez votre médecin ou votre pharmacien si vous avez actuellement ou si vous avez eu dans le passé :
· une maladie coronarienne (dont les symptômes peuvent être une douleur ou une oppression thoracique, une difficulté à respirer, ou une suffocation), une insuffisance cardiaque, ou une pression artérielle basse.
· des troubles du rythme cardiaque tels qu’un rythme cardiaque lent.
· des problèmes respiratoires, de l’asthme ou une maladie pulmonaire obstructive chronique.
· des problèmes de circulation sanguine (tels que la maladie de Raynaud ou le syndrome de Raynaud).
· du diabète parce que le timolol peut masquer les signes et les symptômes d’un faible taux de sucre dans le sang.
· une hyperactivité de la glande thyroïde parce que le timolol peut masquer les signes et symptômes d’une maladie de la thyroïde.
· une myasthénie grave (faiblesse neuromusculaire chronique).
· une chirurgie de la cataracte
· une inflammation de l’œil
Si vous devez subir une intervention chirurgicale, prévenez votre médecin que vous utilisez TRAVOPROST/TIMOLOL VIATRIS car le timolol peut modifier les effets de certains médicaments utilisés pendant l’anesthésie.
Si vous avez une réaction allergique sévère (éruption cutanée, rougeur et démangeaisons de l’oeil) en utilisant TRAVOPROST/TIMOLOL VIATRIS, quelle qu'en soit la cause, le traitement par adrénaline peut ne pas s'avérer efficace. Prévenez votre médecin que vous utilisez TRAVOPROST/TIMOLOL VIATRIS si vous devez recevoir un autre traitement.
TRAVOPROST/TIMOLOL VIATRIS peut modifier la couleur de votre iris (partie colorée de votre oeil). Ce changement peut être permanent.
TRAVOPROST/TIMOLOL VIATRIS peut augmenter la longueur, l’épaisseur, la couleur et/ou le nombre de vos cils et peut entraîner une pilosité ciliaire anormale sur vos paupières.
Le travoprost peut être absorbé par la peau et il ne devra donc pas être utilisé par les femmes enceintes ou souhaitant le devenir. Si ce médicament entre en contact avec la peau, alors il doit être enlevé aussitôt par lavage.
TRAVOPROST/TIMOLOL VIATRIS ne doit pas être utilisé chez les enfants et adolescents de moins de 18 ans.
Autres médicaments et TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien, y compris des médicaments obtenus sans ordonnance.
TRAVOPROST/TIMOLOL VIATRIS peut affecter ou être affecté par d'autres médicaments que vous prenez, y compris d'autres collyres pour traiter le glaucome. Prévenez votre médecin si vous utilisez ou avez l'intention d’utiliser
· des médicaments pour diminuer votre pression artérielle
· un traitement pour le cœur y compris la quinidine (utilisée pour traiter des maladies cardiaques et certaines formes de paludisme)
· un traitement contre le diabète ou encore des antidépresseurs appelés fluoxétine et paroxétine.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
N’utilisez pas TRAVOPROST/TIMOLOL VIATRIS si vous êtes enceinte sauf si votre médecin considère que cela est nécessaire. Si vous pouvez être enceinte, utilisez un moyen de contraception adéquat pendant l’utilisation de ce médicament.
N’utilisez pas TRAVOPROST/TIMOLOL VIATRIS si vous allaitez. Ce médicament peut passer dans votre lait.
Conduite de véhicules et utilisation de machines
Vous pouvez trouver que votre vision est trouble juste après avoir utilisé TRAVOPROST/TIMOLOL VIATRIS. TRAVOPROST/TIMOLOL VIATRIS peut également provoquer des hallucinations, un étourdissement, une nervosité ou une fatigue chez certains patients.
Ne conduisez pas de voiture et nÂ’utilisez pas de machines avant que cet effet ait disparu.
TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/mL + 5 mg/mL, collyre en solution contient du chlorure de benzalkonium et de l'hydroxystéarate de macrogolglycérol 40.
Ce médicament contient 150 mg de chlorure de benzalkonium dans chaque ml de solution.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrôme de l’oeil sec ou de troubles de la cornée (couche transparente à l’avant de l’oeil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
L’hydroxystéarate de macrogolglycérol 40 peut provoquer des réactions cutanées.
3. COMMENT UTILISER TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution ? <
La posologie recommandée est
Une goutte dans l’œil ou les yeux atteint(s), une fois par jour, le matin ou le soir. Utilisez tous les jours à la même heure.
Utilisez TRAVOPROST/TIMOLOL VIATRIS dans les deux yeux uniquement si votre médecin vous a dit de le faire. Utilisez-le aussi longtemps que votre médecin vous l’a dit.
Utilisez TRAVOPROST/TIMOLOL VIATRIS seulement en gouttes pour les yeux.
Instructions dÂ’utilisation
|
1 |
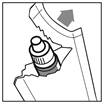
· Ouvrez le sachet d’emballage (figure 1) juste avant d’utiliser le flacon pour la première fois, sortez-en le flacon et inscrivez la date d’ouverture sur l’étiquette dans l’espace prévu à cet effet. · Prenez le flacon et un miroir. · Lavez-vous les mains · Dévissez le bouchon |
|
2 |
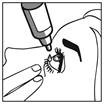
· Tenez le flacon tête en bas, entre le pouce et vos autres doigts. · Penchez la tête en arrière. Avec un doigt propre, tirez doucement votre paupière vers le bas pour créer un sillon entre la paupière et votre œil. La goutte sera déposée à cet endroit (figure 2). · Rapprochez l’embout du flacon de l’œil. Utilisez le miroir pour vous aider. |
|
3 |
· Ne touchez pas votre œil, vos paupières, les surfaces voisines ou d’autres surfaces avec le compte-gouttes. Cela peut infecter le collyre. · Appuyez légèrement sur le flacon pour libérer une goutte de médicament à la fois (figure 3). |
|
4 |
· Après avoir utilisé le médicament, appuyez avec un doigt sur le coin de votre œil, près du nez pendant 2 minutes (figure 4). Cela permet d’empêcher TRAVOPROST/TIMOLOL VIATRIS d’aller dans le reste du corps. · Si vous devez traiter les deux yeux, recommencez ces étapes pour l’autre œil. · Refermez bien le flacon immédiatement après usage. · Utilisez un seul flacon de médicament à la fois. Ne pas ouvrir le sachet tant que vous n’avez pas besoin du flacon. · Vous devez jeter le flacon 4 semaines après la première ouverture, pour prévenir les infections, utiliser un nouveau flacon. |
Si une goutte tombe à côté de votre œil, recommencez.
Si vous avez utilisé plus de TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/mL + 5 mg/mL, collyre en solution que vous n’auriez dû
Si vous avez mis trop de TRAVOPROST/TIMOLOL VIATRIS dans les yeux, rincez-les avec de l’eau tiède. Ne mettez pas d’autre goutte jusqu’à ce que le moment soit venu de mettre la goutte suivante.
Si vous oubliez dÂ’utiliser TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/mL + 5 mg/mL, collyre en solution
Si vous oubliez de mettre TRAVOPROST/TIMOLOL VIATRIS, continuez avec la goutte suivante comme prévu. Ne mettez pas de dose double pour compenser la dose oubliée. La posologie ne doit pas excéder une goutte par jour dans l'œil (les yeux) atteint(s).
Si vous arrêtez d’utiliser TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/mL + 5 mg/mL, collyre en solution
Si vous arrêtez de prendre TRAVOPROST/TIMOLOL VIATRIS sans en parler à votre médecin, la pression de votre œil ne sera pas contrôlée ce qui pourrait provoquer une perte de la vue.
Si vous utilisez un autre collyre en plus de TRAVOPROST/TIMOLOL VIATRIS, attendez au moins 5 minutes entre TRAVOPROST/TIMOLOL VIATRIS et lÂ’autre collyre.
Si vous êtes porteur de lentilles de contact souples, n’utilisez pas le collyre lorsque vous portez vos lentilles. Après avoir utilisé le collyre, attendez 15 minutes avant de remettre vos lentilles.
Si vous avez d'autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? <
Vous pouvez généralement continuer à prendre le collyre, à moins que les effets ne soient graves. Si vous vous inquiétez, contactez votre médecin ou votre pharmacien. N’interrompez pas l’utilisation de TRAVOPROST/TIMOLOL VIATRIS sans en parler à votre médecin.
Effets indésirables très fréquents
(peuvent affecter plus dÂ’ 1 personne sur 10)
Effets oculaires
Rougeur de lÂ’Âœil.
Effets indésirables fréquents
(peuvent affecter jusquÂ’Ã 1 personne sur 10)
Effets oculaires
Inflammation de la surface de l’œil avec atteinte superficielle, douleur oculaire, vision floue, vision anormale, œil sec, démangeaison oculaire, gêne oculaire, signes et symptômes d’irritation oculaire (par exemple sensation de brûlure, de picotement).
Effets indésirables peu fréquents
(peuvent affecter jusquÂ’Ã 1 personne sur 100)
Effets oculaires
Inflammation de la surface de l’œil, inflammation des paupières, conjonctive gonflée, augmentation de la pousse des cils, inflammation de l’iris, inflammation de l’œil, sensibilité à la lumière, vision réduite, fatigue oculaire, allergie oculaire, gonflement oculaire, augmentation de la production des larmes, rougeur des paupières, changement de la couleur des paupières, assombrissement de la peau (autour de l’oeil).
Effets indésirables généraux
Réaction allergique, étourdissement, maux de tête, augmentation ou diminution de la pression artérielle, essoufflement, croissance excessive des poils, écoulement au fond de la gorge, inflammation et démangeaisons cutanées, diminution du rythme cardiaque.
Effets indésirables rares
(peuvent affecter jusquÂ’Ã 1 personne sur 1000)
Effets oculaires
Amincissement de la surface de l’œil, inflammation des glandes des paupières, rupture de vaisseau sanguin dans l’œil, croûte sur le bord de la paupière, positionnement anormal des cils, croissance anormale des cils.
Effets indésirables généraux
Nervosité, irrégularité du rythme cardiaque, perte de cheveux, troubles de la voie, difficultés respiratoires, toux, irritation de la gorge, urticaire, tests sanguins hépatiques anormaux, décoloration de la peau, soif, fatigue, gêne à l’intérieur du nez, urines colorées, douleurs dans les mains et les pieds.
Fréquence indéterminée
(fréquence ne peut être estimée sur la base des données disponibles)
Effets oculaires
Paupières tombantes (forçant l’œil à rester à moitié fermé), yeux enfoncés dans les orbites (les yeux apparaissent plus enfoncés), changement de la couleur de l'iris (partie colorée de l'oeil).
Effets indésirables généraux :
Éruption cutanée, insuffisance cardiaque, douleur thoracique, accident cérébrovasculaire, évanouissement, dépression, asthme, augmentation du rythme cardiaque, sensation de fourmillement ou d’engourdissement, palpitations, gonflement des membres inférieurs, mauvais goût.
De plus,
TRAVOPROST/TIMOLOL VIATRIS est une association de deux substances actives, travoprost et timolol. Comme d'autres médicaments administrés dans les yeux, travoprost et timolol (un bétabloquant) sont absorbés dans le sang. Cela peut entrainer des effets indésirables semblables à ceux des médicaments bétabloquants pris par voie orale ou injectés. Toutefois, l'incidence des effets indésirables après application dans les yeux est inférieure à celle observée après une administration par voie orale ou par voie injectable.
Les effets indésirables listés ci-dessous incluent les réactions liées à la classe des bétabloquants utilisés pour traiter les affections oculaires ou les réactions liées au travoprost seul :
Effets oculaires : inflammation de la paupière, inflammation de la cornée, décollement de la partie en-dessous de la rétine qui contient les vaisseaux sanguins à la suite d’une chirurgie filtrante, ce qui peut causer des troubles de la vision, une diminution de la sensibilité cornéenne, une érosion cornéenne (couche supérieure du globe oculaire endommagée), une vision double, écoulement de l’oeil, gonflement autour de l’oeil, démangeaison de la paupière, renversement externe de la paupière associé à une rougeur, irritation et larmes excessives, vision floue (signe d’opacification du cristallin), gonflement d’une partie de l’oeil (uvée), eczéma des paupières, effet de halo, diminution de la vue, pigmentation dans l’oeil, dilatation des pupilles, changement de la couleur des cils, changement de la texture des cils, trouble du champ visuel..
Effets indésirables généraux
Troubles de l'oreille et du labyrinthe : étourdissement (sensation de tête qui tourne), bourdonnement des oreilles.
Cœur et système circulatoire: ralentissement du rythme cardiaque, œdème (accumulation de liquide), modification du rythme ou de la vitesse des battements cardiaques , insuffisance cardiaque congestive (maladie cardiaque avec essoufflement et gonflement des pieds et des jambes en raison d’une accumulation de liquide), autre type de trouble du rythme cardiaque, crise cardiaque, tension artérielle basse, syndrome de Raynaud, mains et pieds froids, diminution de l’irrigation sanguine du cerveau.
Système respiratoire : aggravation d’un asthme, nez bouché ou écoulement nasal, éternuements (causés par une allergie), difficulté à respirer, saignements de nez, sécheresse nasale.
Système nerveux et troubles généraux : difficulté à dormir (insomnie), cauchemars, perte de mémoire, perte de force et d’énergie, anxiété (détresse émotionnelle), hallucinations.
Système gastro-intestinal : nausées, indigestion, diarrhée, sécheresse de la bouche, douleur abdominale, vomissements et constipation.
Réactions allergiques : augmentation des symptômes allergiques, réactions allergiques généralisées incluant des gonflements de la peau qui peuvent survenir sur le visage et les membres, pouvant obstruer les voies aériennes et provoquer des difficultés pour respirer ou avaler, une éruption localisée ou généralisée, des démangeaisons, une réaction allergique soudaine pouvant menacer le pronostic vital.
Peau : éruption cutanée d’apparence blanc-argenté (éruption psoriasiforme) ou aggravation d’un psoriasis, desquamation de la peau, texture anormale des cheveux, inflammation de la peau avec éruption cutanée et rougeur, modification de la couleur des cheveux, perte des cils, démangeaison, croissance anormale des cheveux, rougeur de la peau.
Muscles : augmentation des signes et des symptômes de myasthénie gravis (trouble musculaire), sensations inhabituelles comme des picotements, faiblesse/fatigue musculaire, douleurs musculaires non provoquées par l'exercice, douleurs articulaires.
Troubles du rein et des voies urinaires : difficulté à uriner et douleur en urinant, fuite urinaire incontrôlée.Reproduction : troubles sexuels, diminution de la libido.
Métabolisme : faible taux de sucre dans le sang, augmentation du marqueur du cancer de la prostate.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution ? <
Tenir hors de la vue et de la portée des enfants.
Ne pas utiliser ce médicament après la date de péremption, mentionnée sur le flacon, le sachet et la boîte après « EXP ». La date de péremption fait référence au dernier jour du mois.
Avant ouverture, ce médicament ne nécessite pas de précautions particulières de conservation concernant la température. Gardez le flacon dans le sachet à l’abri de la lumière.
Après la première ouverture, ce médicament ne nécessite pas de précautions particulières de conservation.
Vous devez jeter le flacon 4 semaines après l’avoir ouvert pour la première fois pour éviter les infections et utiliser un nouveau flacon. Inscrivez la date à laquelle vous l’avez ouvert dans l’espace prévu à cet effet sur chaque étiquette du flacon et sur la boîte.
Les médicaments ne doivent pas être jetés au tout à l’égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu’il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. CONTENU DE LÂ’EMBALLAGE ET AUTRES INFORMATIONS <
Ce que contient TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution <
· Les substances actives sont : travoprost et timolol.
Chaque ml de solution contient 40 microgrammes de travoprost et 5 mg de timolol (sous forme de maléate de timolol).
· Les autres composants sont :
Chlorure de benzalkonium, hydroxystéarate de macrogolglycérol 40, trométamol, édétate disodium, acide borique (E284), mannitol (E421), hydroxyde de sodium (ajustement du pH), eau pour préparations injectables ou eau purifiée.
Qu’est-ce que TRAVOPROST/TIMOLOL VIATRIS 40 microgrammes/ml + 5 mg/ml collyre en solution et contenu de l’emballage extérieur <
Ce médicament se présente sous forme d'une solution aqueuse claire, incolore, pratiquement exempte de particules dans un flacon en plastique de 5 mL avec un embout de dispensation incolore et un bouchon opaque blanc avec bague d’inviolabilité.
Chaque flacon est placé dans un sachet. Chaque flacon contient 2,5 mL de solution.
Le produit est disponible dans les présentations suivantes :
Boîtes de 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché <
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché <
1 RUE DE TURIN
69007 LYON
68 APRILSKO VASTANIE BLVD.,
RAZGRAD, 7200
BULGARIE
OU
PHARMATHEN SA
6 DERVENAKION STR
PALLINI, 153 51
GRECE
OU
JADRAN - GALENSKI LABORATORIJ D.D
SVILNO 20
RIJEKA, 51000
CROATIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen <
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : <
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).