NOTICE
ANSM - Mis à jour le : 16/04/2020
NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose
Chlorhydrate de naloxone anhydre
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez des questions, si vous avez un doute, demandez plus d’informations à votre médecin ou à votre pharmacien.
· Si vous ressentez un quelconque effet indésirable, parlez à votre médecin ou votre pharmacien. Ceci s’applique à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser NALSCUE 0,9 mg/0,1 mL, solution pour pulvérisation nasale en récipient unidose ?
3. Comment utiliser NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose ?
6. Contenu de lÂ’emballage et autres informations.
1. QU’EST-CE QUE NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ? <
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose ? <
Ayez toujours NALSCUE avec vous pour pouvoir l’utiliser en cas d’urgence liée à un surdosage aux opioïdes.
Les membres de la famille, le personnel soignant ou toute autre personne qui peut avoir besoin d’utiliser NALSCUE dans le cas d’un surdosage aux opiacés doivent savoir où le médicament est conservé par le patient et comment l’administrer.
Les signes ou symptômes peuvent être :
· Une somnolence inhabituelle de la personne que l’on n’arrive pas à réveiller en criant ou en la frottant vigoureusement sur la poitrine (sternum)
· Une respiration très lente ou superficielle ou arrêtée
· La pupille (cercle noir au milieu de l’œil) très petite, on parle parfois de pupilles contractées ou de pupilles en têtes d’épingles.
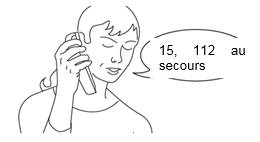
Les secours doivent être immédiatement et systématiquement contactés en composant le 15 ou le 112 avant d’administrer NALSCUE et le patient doit être surveillé jusqu’à l’arrivée des secours.
Ne pas tester NALSCUE avant la prise ou lÂ’administration.
N’utilisez jamais NALSCUE 0,9 mg/0,1 mL, solution pour pulvérisation nasale en récipient unidose dans les cas suivants :
· allergie au chlorhydrate de naloxone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· chez les prématurés et les nouveau-nés (jusqu’à un mois) en raison de la présence d’alcool benzylique.
Avertissements et précautions
Prendre des précautions particulières avec NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose :
Avant que NALSCUE ne vous soit prescrit et/ou dispensé, précisez toutes les informations concernant votre état de santé, notamment :
· Si vous souffrez de problèmes cardiaques : la prise de NALSCUE nécessite une surveillance particulière.
· Si vous prenez de la buprénorphine : l’amélioration de la fréquence respiratoire par NALSCUE peut être incomplète lors d’un surdosage avec la buprénorphine et peut nécessiter une dose supplémentaire par les services de secours.
NALSCUE peut occasionner un syndrome de sevrage aux opioïdes chez une personne ayant consommé un opioïde. Les symptômes de sevrage sont entre-autres frissons, nausées, diarrhées, anxiété, agitation, irritabilité, sueurs, tremblements, augmentation du rythme cardiaque et de la tension artérielle.
Enfants et adolescents
NALSCUE peut être utilisé chez l’enfant d’un mois et plus. Toutefois, après administration, de NALSCUE, une surveillance de l’enfant de plusieurs heures en milieu hospitalier est indispensable.
NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose contient 0,5 mg/0,1 ml d’alcool benzylique. Chez les nourrissons et les enfants jusqu’à 3 ans, il peut provoquer des réactions toxiques et des réactions de type anaphylactoïde.
Autres médicaments et NALSCUE 0,9 mg/0,1ml, solution pour pulvérisation nasale en récipient unidose
NALSCUE diminue l’effet antalgique des analgésiques morphiniques de palier II et III.
Veuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s'il s'agit d'un médicament obtenu sans ordonnance.
NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose avec des aliments et les boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, informez votre médecin avant la prescription et/ou la dispensation de ce médicament.
Grossesse
Si vous êtes enceinte ou si vous envisagez le devenir, il faut savoir que l’utilisation de NALSCUE peut causer des syndromes de sevrage chez le fœtus ou le nouveau-né. Le fœtus ou le nouveau-né doit être mis sous surveillance médicale.
Demandez conseil à votre médecin ou à votre pharmacien.
Allaitement
L’allaitement doit être interrompu pendant une période de temps appropriée après administration de NALSCUE chez la femme qui allaite. Demandez conseil à votre médecin ou à votre pharmacien.
Sportifs
Sans objet.
Conduite de véhicules et utilisation de machines
Les patients qui reçoivent de la naloxone pour traiter les effets des opioïdes doivent être avertis de ne pas conduire d’automobiles ou de machines et de ne pas entreprendre d’activités demandant une attention particulière ou une aptitude physique spécifique.
3. COMMENT UTILISER NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose ? <
Un pulvérisateur est à usage unique et ne peut délivrer qu’une seule pulvérisation.
Ne pas tester avant utilisation.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
· Appelez immédiatement et systématiquement le 15 ou le 112 pour prévenir les services de secours.
· Allonger le patient sur le dos
· Utiliser 2 pulvérisateurs, un pulvérisateur par narine : insérez complètement le premier pulvérisateur dans la première narine, vers le côté de la narine opposé à la cloison nasale. Appuyez fermement sur le piston avec le pouce pour administrer le médicament. Utiliser le deuxième pulvérisateur dans l’autre narine.
· Noter l’heure d’administration de NALSCUE.
· Rester auprès du patient, surveiller son état d’éveil et sa fréquence respiratoire : le patient doit être capable de respirer sans aide à une fréquence de 10 à 12 inspirations par minute. Dans ce cas, installer le patient en position latérale de sécurité.
· Si la fréquence respiratoire ou l’état d’éveil du patient ne s’améliore pas au bout de 3-5 minutes après l’administration de NALSCUE, ou si après une légère amélioration, la fréquence respiratoire ou l’état du patient se dégrade, répéter l’administration de 2 nouveaux pulvérisateurs (un pulvérisateur par narine).
· Installer le patient en position latérale de sécurité, c’est à dire légèrement sur le côté.
· Attendez l’arrivée des secours et remettez-leur les pulvérisateurs usagés.
· Les symptômes d’un surdosage aux opioïdes peuvent réapparaitre à distance d’une première amélioration. Dans tous les cas, une surveillance du patient de plusieurs heures en milieu hospitalier est nécessaire.
Chaque kit contient 4 pulvérisateurs unidoses pour administration par voie nasale uniquement.
Etape 1
Appelez immédiatement et systématiquement le 15 ou le 112 pour prévenir les services de secours.
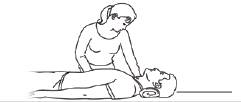
Etape 2
Allongez la personne sur le dos.
Tenez la tête et le cou de la personne afin qu’elle puisse respirer normalement.
Etape 3
Sortez les 2 pulvérisateurs de NALSCUE de la boîte, un pulvérisateur pour chaque narine.
Ne pas tester avant utilisation.
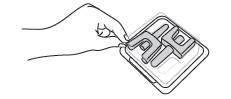
Un pulvérisateur est à usage unique et ne peut délivrer qu’un seul spray.
Etape 4
Tenez le pulvérisateur délicatement entre les doigts et le pouce.
Ne pressez pas encore le piston.
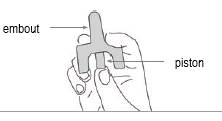
Etape 4
Etape 5
Placez le pulvérisateur complètement dans la narine de la personne vers les parois de la narine, à l’opposé de la cloison nasale.
Appuyez maintenant fermement sur le piston avec le pouce jusqu’au “click”.
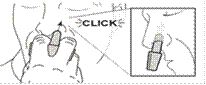
Répétez les étapes 4 et 5 en utilisant le deuxième pulvérisateur dans l’autre narine.
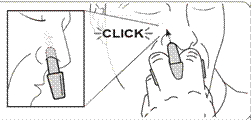
Etape 6
Noter lÂ’heure dÂ’administration de NALSCUE.
Etape 7
Restez avec la personne et surveillez ses réactions.
La personne doit être capable de respirer sans aide à une fréquence de 10 à 12 inspirations par minute.
Si les symptômes ne s’améliorent pas au bout de 3-5 minutes après l’administration de NALSCUE ou si les signes de surdosage réapparaissent, répétez le processus (étapes 2 à 4) avec 2 nouveaux pulvérisateurs.
Etape 8
Placer la personne en position latérale de sécurité, c’est-à -dire légèrement sur le côté.
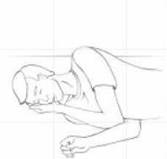
Etape 9
Attendez l’arrivée des secours et remettez-leur les pulvérisateurs usagés.
Une surveillance du patient de plusieurs heures en milieu hospitalier est nécessaire.
Si vous oubliez d’utiliser NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose :
Si vous arrêtez d’utiliser NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose :
Sans objet.
Risque de syndrome de sevrage
NALSCUE peut occasionner un syndrome de sevrage aux opioïdes chez une personne ayant consommé un opioïde. Les symptômes de sevrage figurent dans la rubrique « Quels sont les effets indésirables éventuels ? » ci-après.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? <
Les effets indésirables suivants ont été rapportés après l’administration de NALSCUE :
Très fréquemment (plus de 1 cas sur 10) :
· Altération du goût (goût amer, goût métallique, goût salé, ou goût inhabituel dans la bouche)
Fréquemment (1 cas sur 100 à moins de 1 cas sur 10) :
· Maux de tête
· Trouble de la sensibilité tactile telle que fourmillements, picotements, engourdissements
· Trouble de l’odorat
· Congestion nasale
La naloxone est aussi disponible en solution injectable. Les effets indésirables suivants ont été rapportés après commercialisation de naloxone, solution injectable (les fréquences suivantes ont été observées dans la population générale; cependant, le syndrome de sevrage aux opioïdes serait plus fréquent chez les patients présentant un trouble de l'usage des opioïdes) :
Fréquemment (1 cas sur 100 à moins de 1 cas sur 10) :
· Maux de tête
· Nausées, vomissements
Peu fréquemment (1 cas sur 1000 à moins de 1 cas sur 100) :
· Accélération du rythme cardiaque
· Syndrome de sevrage aux opioïdes incluant entre-autres frissons, nausées, diarrhées, anxiété, agitation, irritabilité, sueurs, tremblements, augmentation du rythme cardiaque et de la tension artérielle.
Rarement (1 cas sur 10000 Ã moins de 1 cas sur 1000) :
· Convulsions
· Troubles du rythme cardiaque et de la tension artérielle
· Diminution ou augmentation de la tension artérielle
· Douleurs postopératoires, Difficultés à respirer
Très rarement (moins de 1 cas sur 10000) :
· Œdème pulmonaire
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.ansm.sante.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose ? <
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption sur la boîte, la plaquette, ou le pulvérisateur, après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à -l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE LÂ’EMBALLAGE ET AUTRES INFORMATIONS <
Ce que contient NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose ? <
La substance active est :
Chlorhydrate de naloxone anhydre......................................................................................... 0,9 mg
Pour un récipient unidose (pulvérisateur) de 0,1 ml
Les autres composants sont :
Acide citrique anhydre, EDTA disodique dihydraté, alcool benzylique (voir rubrique 2.), chlorure de sodium, acide chlorhydrique, hydroxyde de sodium, eau purifiée.
Qu’est-ce que NALSCUE 0,9 mg/0,1 ml, solution pour pulvérisation nasale en récipient unidose et contenu de l’emballage extérieur <
Titulaire de l’autorisation de mise sur le marché <
27 WINDSOR PLACE
DUBLIN 2
IRLANDE
Exploitant de l’autorisation de mise sur le marché <
7 AVENUE DE LA CRISTALLERIE
92310 SEVRES
23 - 24 TAFARNAUBACH INDUSTRIAL ESTATE
TREDEGAR, GWENT, NP22 3AA
Royaume-Uni
Noms du médicament dans les Etats membres de l'Espace Economique Européen <
Sans objet.
La dernière date à laquelle cette notice a été révisée est : <
[à compléter ultérieurement par le titulaire]
Sans objet.