NOTICE
ANSM - Mis à jour le : 01/04/2024
DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
Chlorhydrate d'azélastine/propionate de fluticasone
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
3. Comment utiliser DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
6. Contenu de lÂ’emballage et autres informations.
1. QU’EST-CE QUE DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ? <
DYMISTA, suspension pour pulvérisation nasale contient deux principes actifs : le chlorhydrate d'azélastine et le propionate de fluticasone.
· Le chlorhydrate d'azélastine appartient à un groupe de médicaments appelés anti-histaminiques. Les anti-histaminiques agissent en empêchant les effets de substances comme l'histamine que le corps produit au cours d’une réaction allergique, ce qui a pour but de réduire ainsi les symptômes de la rhinite allergique.
· Le propionate de fluticasone appartient à un groupe de médicaments appelés corticostéroïdes, qui réduisent l'inflammation.
Indications thérapeutiques
DYMISTA, suspension pour pulvérisation nasale est utilisé pour le traitement symptomatique de la rhinite allergique saisonnière et perannuelle modérée à sévère lorsqu'un traitement par un anti-histaminique ou un glucocorticoïde seul par voie intranasale n'est pas considéré comme suffisant.
La rhinite allergique saisonnière et la rhinite allergique perannuelle sont des réactions allergiques à certaines substances, comme les pollens (rhume des foins), les acariens, les moisissures, la poussière ou les animaux domestiques.
DYMISTA, suspension pour pulvérisation nasale soulage les symptômes de l’allergie comme l’écoulement nasal, les écoulements rhino-pharyngés, les éternuements, les démangeaisons du nez ou le nez bouché.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ? <
N’utilisez jamais DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale :
· si vous êtes allergique (hypersensible) au chlorhydrate d'azélastine, au propionate de fluticasone ou à l'un des autres composants contenus dans ce médicament (voir rubrique 6).
Avertissements et précautions
Parlez-en à votre médecin ou votre pharmacien avant d'utiliser DYMISTA, suspension pour pulvérisation nasale :
· Si vous avez récemment subi une opération du nez
· Si vous avez une infection du nez. Les infections des voies nasales doivent être traitées par un traitement antibactérien ou antifongique. Si vous êtes traité pour votre infection du nez, vous pouvez continuer à utiliser DYMISTA, suspension pour pulvérisation nasale pour traiter vos allergies.
· Si vous avez la tuberculose ou une infection non traitée.
· Si vous ressentez une modification de votre vision ou si vous avez un antécédent d'élévation de la pression dans les yeux, de glaucome et/ou de cataractes. Si vous êtes dans ce cas, vous serez étroitement surveillé(e) pendant l'utilisation de DYMISTA, suspension pour pulvérisation nasale.
· Si vous présentez des troubles de la fonction des glandes surrénales, la prudence est requise lors du passage d'un traitement par corticoïde par voie générale à un traitement par DYMISTA, suspension pour pulvérisation nasale.
· Si vous avez une insuffisance hépatique sévère. Votre risque d'avoir des effets indésirables généraux est plus important.
Si vous présentez un de ces problèmes, votre médecin décidera si vous pouvez utiliser DYMISTA, suspension pour pulvérisation nasale.
Il est important que vous preniez votre dose comme indiqué ci-dessous à la rubrique 3 ou en suivant les indications de votre médecin. Le traitement à des doses de corticostéroïdes par voie nasale supérieures aux doses recommandées peut entraîner une inhibition de la fonction surrénalienne, ce qui peut causer : perte de poids, fatigue, faiblesse musculaire, hypoglycémie, envies de sel, douleurs articulaires, dépression et coloration foncée de la peau. Si cela se produisait, votre médecin pourrait vous recommander de prendre un autre médicament pendant les périodes de stress ou en cas de chirurgie programmée.
Pour éviter une inhibition de la fonction surrénalienne, votre médecin vous conseillera d'utiliser la dose la plus faible permettant un contrôle efficace de vos symptômes de rhinite.
Les corticostéroïdes par voie nasale (comme DYMISTA, suspension pour pulvérisation nasale) peuvent ralentir la croissance des enfants et des adolescents, lorsqu'ils sont pris de façon prolongée. Le médecin vérifiera régulièrement la taille de votre enfant et s'assurera qu'il ou elle prend la dose efficace la plus faible possible.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Si vous avez un doute sur l’application de ce qui précède à votre cas, consultez votre médecin ou votre pharmacien avant d'utiliser DYMISTA, suspension pour pulvérisation nasale.
Enfants
Ce médicament n’est pas recommandé chez l’enfant de moins de 12 ans.
Autres médicaments et DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
Veuillez avertir votre médecin ou votre pharmacien, si vous prenez, si vous avez pris récemment ou si vous êtes susceptible de prendre tout autre médicament, y compris des médicaments obtenus sans prescription.
Certains médicaments peuvent augmenter les effets de Dymista, suspension pour pulvérisation nasale et il est possible que votre médecin souhaite vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments pour soigner l’infection à VIH : ritonavir corbicistat et des médicaments pour le traitement des infections fongiques : ketoconazole).
DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale avec des aliments, boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou si vous envisagez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant de prendre DYMISTA, suspension pour pulvérisation nasale.
Conduite de véhicules et utilisation de machines
DYMISTA, suspension pour pulvérisation nasale a une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Très rarement, vous pourrez ressentir une fatigue ou des vertiges provoqués par la rhinite allergique elle-même ou pendant l'utilisation de DYMISTA, suspension pour pulvérisation nasale. Dans ce cas, il est recommandé de ne pas conduire ou d'utiliser des machines. La prise d'alcool peut également augmenter cet effet.
DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale contient du chlorure de benzalkonium
Ce médicament contient 14 microgrammes de chlorure de benzalkonium dans chaque pulvérisation, ce qui est équivalent à 0,014 mg/0,14 g. Le chlorure de benzalkonium peut provoquer une irritation ou un gonflement à l’intérieur du nez, en particulier lors d’une utilisation prolongée. Si vous ressentez une gêne lors de l'utilisation du spray, parlez-en à votre médecin ou à votre pharmacien.
3. COMMENT UTILISER DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ? <
Respectez toujours la posologie indiquée par votre médecin. Si vous avez un doute, consultez votre médecin ou votre pharmacien.
Pour un effet thérapeutique optimal, DYMISTA, suspension pour pulvérisation nasale doit être administré régulièrement.
Éviter tout contact avec les yeux.
Adultes et adolescents (12 ans et plus)
· La dose recommandée est d'une pulvérisation dans chaque narine matin et soir.
Enfants de moins de 12 ans
· Ce médicament n’est pas recommandé chez l’enfant de moins de 12 ans.
Utilisation en cas d’insuffisance rénale ou hépatique
Aucune donnée n'est disponible chez les patients atteints d'insuffisance rénale et d’insuffisance hépatique.
Mode et voie d'administration
Voie nasale.
Veuillez lire attentivement les instructions qui suivent et respecter la prescription.
MODE DÂ’EMPLOI
Préparation du spray
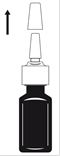
1. Agitez doucement le flacon pendant 5 secondes en le retournant plusieurs fois puis retirez le capuchon de protection de lÂ’embout du spray (voir figure 1).
Figure 1
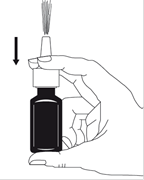
2. Lors de la première utilisation du spray, la pompe doit être amorcée en l'actionnant dans le vide et vers le haut.
3. Amorcez la pompe en plaçant un doigt de chaque côté et en plaçant votre pouce au fond du flacon.
4. Appuyez et relâchez 6 fois jusqu'à ce qu'un fin brouillard soit libéré (voir figure 2).
5. Votre pompe est maintenant amorcée et prête à l'emploi.
Figure 2
6. Si le spray nasal n'a pas été utilisé depuis plus de 7 jours, il devra être de nouveau amorcé en actionnant la pompe une fois.
Utilisation du spray
1. Agitez doucement le flacon pendant 5 secondes en le retournant plusieurs fois puis retirez le capuchon de protection de lÂ’embout nasal du spray (voir figure 1).
2. Mouchez-vous pour vider vos narines.
3. Inclinez votre tête vers le bas en direction de vos orteils. N'inclinez pas la tête vers l'arrière.
4. Maintenez le flacon verticalement et insérez délicatement l'embout du spray dans une de vos narines.
5. Fermez l'autre narine avec un doigt, appuyez rapidement sur la pompe en inspirant doucement (voir figure 3).
6. Expirez par la bouche.
Figure 3

7. Répétez les étapes ci-dessus pour l'autre narine.
8. Inspirez doucement et n'inclinez pas la tête vers l'arrière après administration. Ceci empêche que le médicament ne coule dans votre gorge et ne produise un goût désagréable (voir figure 4).
Figure 4

9. Après usage, essuyez l'embout du spray à l'aide d'un mouchoir en papier ou d'un chiffon propre puis remettez en place le capuchon protecteur.
10. Ne percer pas l’embout si la pulvérisation ne s’effectue pas. Nettoyer l’applicateur avec de l’eau.
Il est important que vous preniez la dose prescrite par votre médecin. N'utilisez pas le spray nasal plus que ce que le médecin recommande.
Durée du traitement
DYMISTA, suspension pour pulvérisation nasale est adapté pour une utilisation à long terme. La durée du traitement doit correspondre à la période pendant laquelle vous avez des symptômes d'allergie.
Si vous avez utilisé plus de DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale que vous n’auriez dû :
Si vous pulvérisez une trop grande quantité de ce médicament dans votre nez, vous n'aurez probablement aucun problème. Si vous êtes inquiet(ète) ou si vous avez utilisé des doses supérieures à la dose recommandée pendant une longue période, contactez votre médecin.
Si quelqu'un, en particulier un enfant, boit accidentellement DYMISTA, suspension pour pulvérisation nasale, contactez dès que possible votre médecin ou le service des urgences de l'hôpital le plus proche.
Si vous oubliez d’utiliser DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale :
Utilisez le spray nasal dès que vous vous en rendez compte, puis prenez la dose suivante à l'heure prévue. Ne prenez pas de double dose pour compenser celle que vous avez oublié de prendre.
Si vous arrêtez d’utiliser DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale :
N'arrêtez pas d'utiliser DYMISTA, suspension pour pulvérisation nasale sans en parler à votre médecin, car cela pourrait faire échouer le traitement.
Si vous avez d'autres questions sur l’utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? <
Effets indésirables très fréquents (pouvant survenir chez plus d’1 personne sur 10) :
· Saignement de nez.
Effets indésirables fréquents (pouvant survenir chez jusqu'à 1 personne sur 10) :
· Céphalée
· Goût amer dans la bouche, en particulier si vous inclinez la tête en arrière lors de l'utilisation du spray. Ce goût devrait disparaître si vous buvez une boisson sucrée quelques minutes après utilisation.
· Odeur désagréable
Effets indésirables peu fréquents (pouvant survenir chez jusqu'à 1 personne sur 100) :
· Légère irritation à l'intérieur du nez. Cette irritation peut produire un léger picotement, une démangeaison ou des éternuements.
· Sécheresse du nez, toux, sécheresse de la gorge ou irritation de la gorge.
Effets indésirables rares (pouvant survenir chez jusqu'à 1 personne sur 1 000) :
· Bouche sèche
Effets indésirables très rares (pouvant survenir chez jusqu'à 1 personne sur 10 000) :
· Vertiges ou somnolence.
· Cataracte, glaucome ou augmentation de la pression dans les yeux, pouvant entraîner une perte de vision et/ou des yeux rouges et douloureux. Ces effets indésirables ont été rapportés après un traitement prolongé avec des sprays nasaux de propionate de fluticasone.
· Lésion de la peau et de la muqueuse du nez.
· Nausées, sensation de fatigue, d’épuisement ou de faiblesse
· Éruption, démangeaison cutanée ou papules rouges qui démangent sur la peau
· Bronchospasme (rétrécissement des voies aériennes dans les poumons)
Informez immédiatement votre médecin si vous constatez l’un des symptômes suivants :
· Gonflement du visage, des lèvres, de la langue ou de la gorge, qui peut entraîner des difficultés à avaler et/ou à respirer et apparition soudaine d'une éruption cutanée. Il pourrait s'agir des signes d'une réaction allergique sévère. Remarque : cette réaction est très rare.
Effets indésirables avec une fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Vision floue
· Ulcérations dans le nez
Des effets indésirables systémiques (affectant l’ensemble du corps) peuvent survenir lorsque ce médicament est utilisé à des doses élevées pendant une longue période. Le risque que ces effets surviennent est bien moins élevé avec un spray nasal qu'avec les corticostéroïdes pris par voie orale. Ces effets peuvent varier selon les patients et selon les différentes formulations de corticostéroïdes (voir rubrique 2).
Les corticostéroïdes nasaux peuvent affecter la production normale d'hormones dans votre corps, en particulier si vous utilisez des doses élevées pendant une longue période. Chez l'enfant et l'adolescent, cet effet indésirable peut entraîner une croissance moins rapide.
Dans de rares cas, une diminution de la densité de l'os (ostéoporose) a été observée après utilisation prolongée de corticostéroïdes par voie nasale.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ? <
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et sur la boîte après "EXP". La date de péremption fait référence au dernier jour de ce mois.
Ne pas mettre au réfrigérateur, ni congeler.
Durée de conservation après ouverture : éliminer le médicament inutilisé 6 mois après la première ouverture du spray nasal.
Ne jetez aucun médicament au tout-à -l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE LÂ’EMBALLAGE ET AUTRES INFORMATIONS <
Ce que contient DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale <
· Les substances actives sont :
Chlorhydrate d'azélastine et propionate de fluticasone.
Chaque gramme de suspension contient 1 000 microgrammes de chlorhydrate d'azélastine et 365 microgrammes de propionate de fluticasone.
Chaque pulvérisation (0,14 g) délivre 137 microgrammes de chlorhydrate d’azélastine (= 125 microgrammes d’azélastine) et 50 microgrammes de propionate de fluticasone.
· Les autres composants sont :
Edétate disodique, glycérol, cellulose microcristalline, carmellose sodique, polysorbate 80, chlorure de benzalkonium (voir rubrique 2), phényl-éthanol et eau purifiée.
Qu’est-ce que DYMISTA 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale et contenu de l’emballage extérieur <
DYMISTA, suspension pour pulvérisation nasale est une suspension blanche homogène.
DYMISTA, suspension pour pulvérisation nasale est présenté dans un flacon en verre brun doté d'une pompe doseuse, d'un embout nasal et d'un capuchon protecteur.
Le flacon de 10 ml contient 6,4 g de suspension (environ 28 doses).
Le flacon de 25 ml contient 23 g de suspension (environ 120 doses).
Présentations :
Boîte de 1 flacon de 6,4 g de suspension pour pulvérisation nasale
Boîte de 1 flacon de 23 g de suspension pour pulvérisation nasale
Conditionnements multiples de 10 flacons contenant chacun 6,4 g de suspension
Conditionnements multiples de 3 flacons contenant chacun 23 g de suspension
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché <
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché <
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
BENZSTRASSE 1
61352 BAD HOMBURG
ALLEMAGNE
ou
MYLAN HUNGARY KFT
2900 KOMAROM
MYLAN UTCA 1
HONGRIE
ou
HAUPT PHARMA AMAREG GMBH
DONAUSTAUFER STRASSE 378
93055 REGENSBURG
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen <
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : <
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).